
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A.1︰2︰3 B.3︰2︰1 C.6︰3︰1 D.6︰3︰2
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①将 通入酸性
通入酸性 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________.
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________.
A.  B.
B.  C.
C.  D.
D. 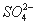
②亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现在有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性,并写出该反应的离子方程式为:_____________________________.
(2)从物质分类的角度可以推测物质的性质。
①已知蛇纹石由 、
、 、
、 、
、 组成。其中属于碱性氧化物的是______________________________。
组成。其中属于碱性氧化物的是______________________________。
②现取一份蛇纹石试样进行实验:
I. 先将其溶于过量的盐酸中、过滤,滤渣的主要成分是______________。
II. 再向滤液中加入 溶液至过量、过滤,滤渣中的主要成分是__________________。
溶液至过量、过滤,滤渣中的主要成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池总反应离子方程式为2Fe3++Fe===3Fe2+,能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
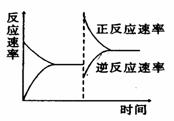
右图是关于反应A2(g)+3B2(g)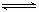 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
A.升高温度,同时加压 B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池负极反应式为:O2 + 2H2O + 4e— = 4OH—
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
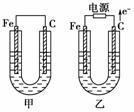
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中书写正确的是
A.金属钠与水反应:Na +2H2O=Na++2OH-+H2↑
B.用氢氧化钡溶液中和硫酸溶液:Ba2++SO42-= BaSO4↓
C.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
D.向碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com