
下列离子方程式中书写正确的是
A.金属钠与水反应:Na +2H2O=Na++2OH-+H2↑
B.用氢氧化钡溶液中和硫酸溶液:Ba2++SO42-= BaSO4↓
C.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
D.向碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=H2O+CO2↑
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A.1︰2︰3 B.3︰2︰1 C.6︰3︰1 D.6︰3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为某元素周期表的一部分,请回答有关问题:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)⑧的元素符号是__ ____;②和④形成的化合物熔融态是否导电 (填“是”或“否”)
(2)表中最活泼的金属的原子结构示意图为_ _ ____
表中非金属性最强的元素是___ __(用代号填写)
(3)表中能形成两性氢氧化物的元素是____ ___(用代号填写),写出该元素的氢氧化物与⑥的最高价氧化物对应水化物反应的化学方程式_______________ __
(4)①、⑦两元素的常见氢化物化合生成的物质含有的化学键类型为_________________ _____
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产生活、环境保护密切相关。下列说法中不正确的是
A.加热能杀死流感病毒是因为病毒的蛋白质受热变性
B.人造纤维、合成纤维和光导纤维都是有机高分子化合物
C.方便面的制作过程中常用到纯碱,葡萄酒中一般加入少量SO2作为添加剂
D.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+ O2(g)==CO(g)
O2(g)==CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)==CO2(g)  H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)==SO2(g)  H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= 。
H= 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时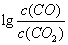 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。

(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期律和周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面都有重要意义。下表为元素周期表的一部分,请参照元素a~h在表中的位置,回答下列问题:


(1)这8种元素中金属性最强的元素是______,元素最高价氧化物对应的水化物中酸性最强的是______(填元素符号或化学式,下同);
(2)c元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___________;
(3)c、e、g三种元素按原子半径由大到小的顺序排列为___________;
(4)由a、d、e三种元素形成的既含离子键又含共价键的离子化合物的电子式为______________。
(5)若用球棍模型表示a和d形成的化合物的分子结构,应该是_____________。

 |
(6)某原电池,如右图所示:Cu是 极(填“正”或“负”),电极反应式为 ;
Zn是 极(填“正”或“负”),电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列反应达到平衡后降温或增压,平衡都向正反应方向移动的是
下列反应达到平衡后降温或增压,平衡都向正反应方向移动的是
A.2NH3(g) 3H2(g) + N2(g) ;ΔH>0 B.3O2(g)
3H2(g) + N2(g) ;ΔH>0 B.3O2(g) 2O3(g) ;ΔH>0
2O3(g) ;ΔH>0
C.H2(g)+I2(g) 2HI(g);ΔH<0 D.2NO2(g)
2HI(g);ΔH<0 D.2NO2(g) N2O4(g);ΔH<0
N2O4(g);ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列实验装置进行的相应实验,不能达到实验目的的是
A.用图1所示装置可制取氨气
B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.用图3所示装置可制取乙烯并验证其易被氧化
D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com