
| KOH |
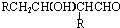
| △ |
| -H2O |
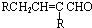
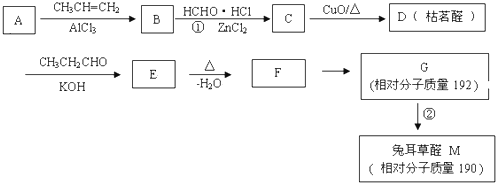
 ,A与丙烯反应生成B,B经过系列反应得到D,由D的结构结合(1)中A分子中碳、氢的质量比为12:1,可知A为
,A与丙烯反应生成B,B经过系列反应得到D,由D的结构结合(1)中A分子中碳、氢的质量比为12:1,可知A为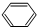 ,与丙烯发生加成反应生成B为
,与丙烯发生加成反应生成B为 ,结合B、D结构可推知C为
,结合B、D结构可推知C为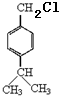 (HCl存在条件下不可能为得到醇羟基),D发生信息中的反应生成E为
(HCl存在条件下不可能为得到醇羟基),D发生信息中的反应生成E为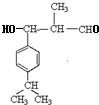 ,E脱去1分子水生成F为
,E脱去1分子水生成F为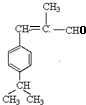 ,M的相对分子质量为190,比F的相对分子质量大2,故组成上M比F多2个H原子,G比M相对分子质量大2,故组成上比G比M多2个H原子,则F中C=C、-CHO与氢气加成生成G为
,M的相对分子质量为190,比F的相对分子质量大2,故组成上M比F多2个H原子,G比M相对分子质量大2,故组成上比G比M多2个H原子,则F中C=C、-CHO与氢气加成生成G为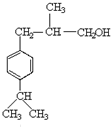 ,G中醇被氧化为-CHO生成M,则M为
,G中醇被氧化为-CHO生成M,则M为 ,据此解答.
,据此解答. ,A与丙烯反应生成B,B经过系列反应得到D,由D的结构,结合(1)中A分子中碳、氢的质量比为12:1,可知A为
,A与丙烯反应生成B,B经过系列反应得到D,由D的结构,结合(1)中A分子中碳、氢的质量比为12:1,可知A为 ,与丙烯发生加成反应生成B为
,与丙烯发生加成反应生成B为 ,结合B、D结构可推知C为
,结合B、D结构可推知C为 (HCl存在条件下不可能为得到醇羟基),D发生信息中的反应生成E为
(HCl存在条件下不可能为得到醇羟基),D发生信息中的反应生成E为 ,E脱去1分子水生成F为
,E脱去1分子水生成F为 ,M的相对分子质量为190,比F的相对分子质量大2,故组成上M比F多2个H原子,G比M相对分子质量大2,故组成上比G比M多2个H原子,则F中C=C、-CHO与氢气加成生成G为
,M的相对分子质量为190,比F的相对分子质量大2,故组成上M比F多2个H原子,G比M相对分子质量大2,故组成上比G比M多2个H原子,则F中C=C、-CHO与氢气加成生成G为 ,G中醇被氧化为-CHO生成M,则M为
,G中醇被氧化为-CHO生成M,则M为 ,
, ,分子式为C6H6,故答案为:C6H6;
,分子式为C6H6,故答案为:C6H6; ,键线式为
,键线式为 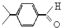 ,故答案为:
,故答案为: ;
; ,含氧官能团有:醛基、羟基,故答案为:醛基、羟基;
,含氧官能团有:醛基、羟基,故答案为:醛基、羟基; ,
, ;
; ,
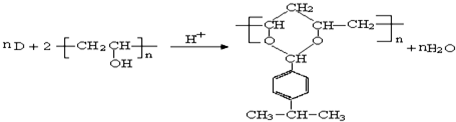
,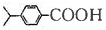 ,I有多种同分异构体,符合下列条件的同分异构体的结构简式(任写一种):①与新制氢氧化铜加热后反应生成红色沉淀,说明含有醛基,②能与FeCl3溶液发生显色反应,含有酚羟基;③苯环上一溴取代物只有一种,④核磁共振氢谱有五种类型氢原子的吸收峰,符合条件同分异构体为:
,I有多种同分异构体,符合下列条件的同分异构体的结构简式(任写一种):①与新制氢氧化铜加热后反应生成红色沉淀,说明含有醛基,②能与FeCl3溶液发生显色反应,含有酚羟基;③苯环上一溴取代物只有一种,④核磁共振氢谱有五种类型氢原子的吸收峰,符合条件同分异构体为: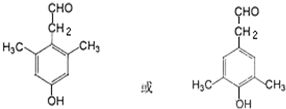 ,
, .
.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 原子核外L层上s能级的电子总数为p能级上的电子总数的一半 |
| Y | 元素的原子半径在短周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数等于s能级上的电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定实验中的锥形瓶使用前应该用待装液洗涤 |
| B、用25 mL滴定管进行滴定实验时,消耗某溶液体积为21.70 mL |
| C、在托盘天平的托盘上各垫一张洁净的纸片直接称量NaOH固体 |
| D、用广泛pH试纸测得某溶液的pH为2.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应开始到10s,用Z表示的反应速率为0.158mol/(L?s) |
| B、反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C、反应开始到10s时,Y转化了0.79mol |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com