
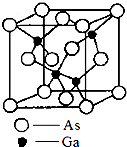
 砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件.
砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件.| m |
| V |
| 5+3 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| (a×10-7)3 |
| 0.96 |
| a3 |
| 0.96 |
| a3 |


科目:高中化学 来源: 题型:
| A、都正确 | B、只有①③ |
| C、只有①②③ | D、只有②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
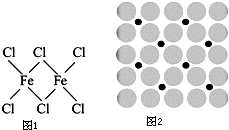 铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:
铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| B | C | ||||||||||||||||
| D | E | ||||||||||||||||

| 元素 | D | E | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置中出口①处的物质是氯气,出口②处的物质是氢气 | ||||
B、装置中发生反应的离子方程式为:2Cl-+2H+
| ||||
| C、该装置是将电能转化为化学能 | ||||
| D、该离子交换膜只能让阳离子通过,不能让阴离子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com