
����Ŀ��Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ��(�������Ѽ���)��4��5��6��պ����Ӧ��Һ�İ�ֽ��U���Ϸ����������1.���۵⻯����Һ��2.NaBr��Һ������������ͷ���е��ɼеIJ����ܣ�

ʵ����̣�
��. �رյ��ɼ�b��������a���μ�Ũ���ᡣ
��. ��4��5��6��ֽ������ɫ�仯���ɼ�b��
��. ����������պ��NaBr��Һ�����ű�ɺ���ɫ��رյ��ɼ�b��
��.����
(1)����a��_______________��
(2)U���в�������ɫ���壬�����ʽ��_______________��
(3)��֤������������ǿ�ڵ��ʵ��������_______________��
(4)Ϊ��֤���������ǿ�ڵ⣬���̢��IJ�����������_______________��
(5)���̢�ʵ���Ŀ����_______________��
(6)�ȡ��塢�ⵥ�ʵ�������������ԭ��(��ԭ�ӽṹ�ĽǶȽ���)_________________
���𰸡���Һ©�� ![]() ��ֽ5��ɻ�ɫ����ֽ4������ ȡ�²����ܣ�����2��������1���� ��Ӧ�����嵥�ʣ���ֹ�������� ͬ����Ԫ�ش��ϵ���ԭ�Ӱ뾶�����õ�����������
��ֽ5��ɻ�ɫ����ֽ4������ ȡ�²����ܣ�����2��������1���� ��Ӧ�����嵥�ʣ���ֹ�������� ͬ����Ԫ�ش��ϵ���ԭ�Ӱ뾶�����õ�����������
��������
(1)����װ��ͼ��������a�����ƣ�
(2)������ؾ���ǿ�����ԣ���Ũ���ᷴӦ���ɻ���ɫ��������������
(3)��֤������������ǿ�ڵ⣬�������û����⻯���еĵ⣬�ⵥ����ʹ������Һ����ɫ��
��4��Ϊ��֤���������ǿ�ڵ⣬Ӧʹ2�����ɵ���ӷ���պ�е��۵⻯����Һ������1�ϣ�
��5��Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ�
��6��ͬ����Ԫ�ش��ϵ��µ��Ӳ������࣬ԭ�Ӱ뾶������
(1)����װ��ͼ������a�������Ƿ�Һ©����
(2)���������Ũ���ᷴӦ����������������˫ԭ�ӷ��ӣ���ԭ������ԭ��֮�乲��1�Ե��ӣ������ĵ���ʽ��![]() ��
��
(3)�������û����⻯���еĵ⣬��֤������������ǿ�ڵ��ʵ�������ǰ�ֽ4���������ֽ5��ƣ���
��4��Ϊ��֤���������ǿ�ڵ⣬Ӧʹ2�����ɵ���ӷ���պ�е��۵⻯����Һ������1�ϣ����̢��IJ�����ȡ�²����ܣ�����2��������������1������
��5��Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ���2����Һ��Ϊ����ɫʱ��˵���д����������ɣ���ʱӦ�رյ��ɼ�b����������������
��6��ͬ����Ԫ�ش��ϵ��µ��Ӳ������࣬ԭ�Ӱ뾶�����õ������������������ȡ��塢�ⵥ�ʵ�������������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����֮����ת��������ʽ��ʾ��
![]()
�ش������й����⣺
��1��Fe2O3����Ԫ�ػ��ϼ�Ϊ___________��ʵ�֢ܵ�ת�������___________(�����������ԭ����)��
��2����ƽ�����ȱ���ʽ
_____FeCl3 +_____ Cl2+___��![]() _____ Na2FeO4+ _____ NaCl +_____H2O
_____ Na2FeO4+ _____ NaCl +_____H2O
��3����֪���з�Ӧ���Է�����Co2O3+6H++2Cl-=2Co2++Cl2��+3H2O
2Fe3++SO32��+H2O��2Fe2++SO42��+2H+��
Cl2+2Fe2+=2Cl-+2Fe3+
��������Ӧ��֪�����ԣ�Co2O3_______(���������) Fe3+,
�������ӷ�Ӧ�������_______��
a. Co2O3+6H++2 Fe2+=2Co2++2Fe3++3H2O
b. SO42��+2Cl-+2H+��Cl2��+SO32��+H2O
c. Cl2+SO32��+H2O��2Cl-+SO42��+2H+��
��4��A��B��C�ǵ��ʣ�����A�ǽ������������ʼ��ת����ϵ��ͼ��

����ͼʾת����ϵ�ش�
д��A��NaOH��Һ��Ӧ�����ӷ���ʽ________________________________��
д��A+Fe3O4���Ļ�ѧ����ʽ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����ָ������������½���ѧ��ת��Ϊ���ܵ�װ�á�ij����ȼ�ϵ�صĹ���ԭ������ͼ��ʾ������˵������ȷ����

A. �õ���ڸ����¹������ٶȸ���
B. HS������������������ת��ΪSO42���ķ�Ӧ�ǣ�HS��+4H2O��8e��= SO42��+9H+
C. b�ǵ�صĸ���
D. ���õ����0.45 mol ����ת�ƣ�����0.45 mol H+����ͨ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���Ӧ�����������

A. ͼ�ױ�ʾһ���¶���FeS��CuS�ij����ܽ�ƽ�����ߣ���Ksp(FeS)>Ksp(CuS)
B. ͼ�ұ�ʾpH=2�ļ�����������Һϡ��ʱ��pH�仯���ߣ������ԣ�����<����
C. ͼ����ʾ��0.1000 mol��L-lNaOH��Һ�ζ�25.00 mL����ĵζ����ߣ��� c(HCl)=0.0800 mol ��L-1
D. ͼ����ʾ��ӦN2(g)+3H2(g) ![]() 2NH3(g)ƽ��ʱNH3�����������ʼn(N2)/n(H2)�仯�����ߣ���ת���ʣ���A(H2)=��B(H2)
2NH3(g)ƽ��ʱNH3�����������ʼn(N2)/n(H2)�仯�����ߣ���ת���ʣ���A(H2)=��B(H2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯���������ǵ����������
(1)����β����NO���ɹ��̵������仯ʾ��ͼ���£�

�������£�1mol N2��1molO2��ȫ��Ӧ����NO����_______________(���������������ų���)________kJ������
(2)һ���¶��£������Ϊ0.5 L�ĺ����ܱ������У�������̬������X��Y֮�䷴Ӧ�����и����ʵ����ʵ�����ʱ��Ĺ�ϵ��ͼ��ʾ��

�ٸ÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��______________________��
����0��3 min�ڣ���Y��ʾ�ķ�Ӧ����Ϊ____________��
������������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����________(����ĸ)��
a��������ѹǿ���ٷ����仯
b��X������������ٷ����仯
c��������ԭ���������ٷ����仯
d����ͬʱ��������nmolY��ͬʱ����2nmol X
�ܷ�Ӧ�ﵽƽ����������¶ȣ�����(��)______����(��)________��(��������������С������������)��
(3)��Ӧ A(g)+3B(g)�T2C(g)+3D(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
���� (A)=0.015mol (Ls)��1 ���� (B)=0.09mol (Ls)��1
���� (C)=2.4mol (Lmin )��1 ���� (D)=0.045mol (Ls)��1
�÷�Ӧ�����ֲ�ͬ����������ɴ�С��˳��Ϊ(��������)________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2ͨ��BaCl2��Һ�в�����������������ͼ�Ҳ��Y�ι��з��ú��ʵ�ҩƷ�����к�����������BaCl2��Һ�п��Կ�����ɫ�������Ҳ�Y�ι��зŵ�ҩƷ��

A. Cu��Ũ���� B. CaO��Ũ��ˮ C. Na2SO3�ͽ�Ũ���� D. KMnO4��Һ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��ʾ������һ���Ǵ�������ǣ� ��
A.C5H10B.C4H8C.C3H8D.C2H4Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�Ϊ���ڱ�ǰ20��Ԫ����ijЩԪ�ص��й����ݣ�
Ԫ������ | �� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 |
���̬ | +1 | +1 | ���� | +1 | +4 | +5 | +7 | +1 | +5 |
��ͼ�̬ | ���� | ���� | ��2 | -1 | -4 | ��3 | ��1 | ���� | ��3 |
�Իش��������⣺(�ö�Ӧ������Ż����Ʊ�ʾ)
(1)����9��Ԫ�ص�ԭ���У���ԭ����ǿ����________(����)��д������ԭ�ӽṹʾ��ͼ��___________________ ��
(2)����ܿɷֱ��γ�10���Ӻ�18���ӵķ��ӣ�д����18���ӷ���ת����10���ӷ��ӵĻ�ѧ����ʽ��________________________________________(�ֽⷴӦ)��
(3)ijԪ��R��ԭ�Ӱ뾶Ϊ1.04��10-10m����Ԫ�������ڱ��е�λ����_______________
(4)�١��ۡ�������Ԫ���γɵ����ӣ���뾶��С�����˳��Ϊ_______________
(5)������ʵ��˵��Ԫ�����ķǽ����Ա���Ԫ�صķǽ�����ǿ����___________��
a.Ԫ�����γɵĵ��ʱ���Ԫ���γɵĵ��ʵ��۵��
b.Ԫ����������Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
c.Ԫ�����ĵ���ͨ�뵽H2S����Һ�г��ֻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X�ļ���ʽΪ��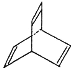
��1���л���Y��X��ͬ���칹�壬�����ڷ�������д��Y�Ľṹ��ʽ________________��
��2��Y����ϩ��һ�������·��������ʵ����ۺϷ�Ӧ��д���䷴Ӧ�Ļ�ѧ����ʽ��__________��
��3��X��������H2��һ�������·�Ӧ�����ɻ�״�ı�����Z����Z��һ�ȴ�����______�֡�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com