
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
分析 短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,原子序数:a>b>d>c,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,且A、B在周期表中C、D的下一周期,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,原子序数:a>b>d>c,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,且A、B在周期表中C、D的下一周期,
A.A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:B>A>C>D,故A错误;
B.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,所以原子序数:a>b>d>c,故B错误;
C.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,所以离子半径C>D>B>A,故C正确;
D.A、B为同周期金属元素,A离子带的正电荷较多,故最外层电子数A>B,C、D为同周期非金属性元素,C离子所带负电荷较多,故最外层电子数C<D,C、D的族序数大于A、B,故最外层电子数D>C>A>B,故D错误.
故选C.
点评 本题考查位置结构性质的相互关系及应用,为高频考点,侧重于学生的分析能力的考查,根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大,注意由于是短周期元素,可以确定具体的元素.


科目:高中化学 来源: 题型:推断题
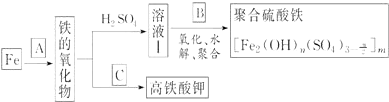
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
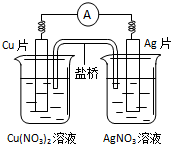
| A. | 电子沿导线由Cu片流向Ag片 | |
| B. | 正极的电极反应是Ag++e-=Ag | |
| C. | Cu片上发生氧化反应,Ag片上发生还原反应 | |
| D. | 反应时盐桥中的阳离子移向Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
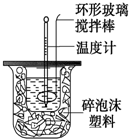 测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )| A. | 实验中使用的搅拌棒材料为铁 | |
| B. | 读取温度计读数时,读取的是混合溶液的最高温度 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5×10-6NA个DEHP分子 | |
| B. | 含有1.2×10-4NA个碳原子的DEHP分子 | |
| C. | 含有2×10-5NA个氧原子的DEHP分子 | |
| D. | 含有2.0×10-4NA个氢原子的DEHP分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
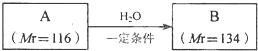
 ,
,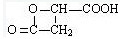 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com