
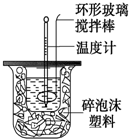
 测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )| A. | 实验中使用的搅拌棒材料为铁 | |
| B. | 读取温度计读数时,读取的是混合溶液的最高温度 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
分析 A.根据金属的导热性很好,会导致热量的散失;
B.在中和热实验中,读取混合溶液的最高温度,记为终止温度;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失;
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小.
解答 解:A.实验中使用的搅拌棒材料为铁,金属的导热性很好,会导致热量的散失,中和热的数值偏小,故A错误;
B.在中和热实验中,读取混合溶液的最高温度,记为终止温度,该操作正确,不会引起误差,故B正确;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,中和热的数值偏小,故C错误;
D.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,中和热的数值偏小,故D错误;
故选B.
点评 本题主要考查了中和热测定实验的仪器、步骤和原理,难度中等,需要注意的是为了减少实验误差.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 化学反应中有物质变化也有能量变化 | |
| B. | 需要加热的化学反应不一定是吸热反应 | |
| C. | 如图所示的反应为放热反应 | |
| D. | 化学反应中的热量变化取决于反应物的能量和生成物的能量的相对高低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 没有单质参加的反应一定不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 化合反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验内容 | 实验现象 |
| 向2mL维生素C溶液中滴加2滴紫色石蕊试液 | 溶液变为红色 |
| 将维生素C的溶液逐滴加入到2mL溶有淀粉的碘水中 | 溶液由蓝色变为无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com