
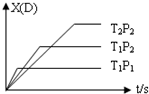
 已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )| A. | 正反应为放热反应 | B. | m+n>p+q | ||
| C. | T1<T2 | D. | P1<P2 |
分析 根据温度、压强对平衡移动的影响分析,温度越高、压强越大,则反应速率越大,达到平衡用的时间越少,曲线的斜率越大.
解答 解:A.相同压强下P2,根据温度对反应速率的影响可知,温度越高,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:T1>T2,升高温度,D的含量减小,平衡向逆反应方向移动,则正反应为放热反应,故A正确;
B.相同温度T1下,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:P1>P2,相同温度T1下,压强越大,生成物D的物质的量越小,说明平衡向逆反应方向移动,则反应前后混合气体的计量数增大,所以m+n<p+q,故B错误;
C.相同压强下P2,根据温度对反应速率的影响可知,温度越高,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:T1>T2,故C错误;
D.相同温度T1下,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:P1>P2,故D错误;
故选A.
点评 本题考查了温度、压强对化学平衡的影响,根据“先拐先平数值大”确定温度、压强的相对大小,再结合温度、压强与生成物D物质的量的变化确定反应热及气体的计量数变化,难度中等.


科目:高中化学 来源: 题型:解答题
 某厂排出的废液主要含硝酸锌和硝酸银,为了从回收金属银和硝酸锌,某中学化学课外活动组设计了以下的实验步骤:
某厂排出的废液主要含硝酸锌和硝酸银,为了从回收金属银和硝酸锌,某中学化学课外活动组设计了以下的实验步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| C(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
| A. | 500 s时O2的浓度为0.075 mol/L | |
| B. | 平衡后,升高温度,正反应速率先增大后减小 | |
| C. | 平衡后,要使平衡常数增大,改变的条件是升高温度 | |
| D. | 1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C为短周期元素,在周期表中所处位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1氨水中,c(OH-)=c(NH4+) | |
| B. | 10 mL 0.02mol•L-1HCl溶液与10 mL 0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 | |
| C. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com