
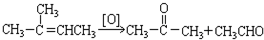
 ���������������·�����Ӧ����д����Ӧ�ķ���ʽ��
���������������·�����Ӧ����д����Ӧ�ķ���ʽ�� +3HNO3
+3HNO3| ŨH2SO4 |
| �� |
 +3H2O��
+3H2O�� +3HNO3
+3HNO3| ŨH2SO4 |
| �� |
 +3H2O��ȡ����Ӧ��
+3H2O��ȡ����Ӧ��| �� |
| �� |
| �� |
| �� |
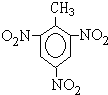
 ���������������·�����ӦΪ
���������������·�����ӦΪ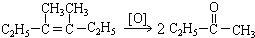 ��
��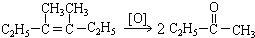 ��
��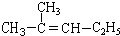 ������Ϊ2-��-2-��ϩ��
������Ϊ2-��-2-��ϩ��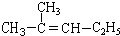 ��2-��-2-��ϩ��
��2-��-2-��ϩ��


 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1.0 mo1?L-1��Na2CO3��Һ�У�c��OH-���Tc��HCO3-��+c��H+��+c��H2CO3�� |
| B�����������Һ�м����������ᣬ�õ������Ի����Һ��c��Na+����c��CH3COO-����c��H+����c��OH-�� |
| C��0.1 mol?L-1NaHCO3��Һ�У�c��Na+����c��HCO3-��c��CO32-����c��H2CO3�� |
| D��һ������NH4��2SO4��NH3?H2O������õ�������Һ�У�c��NH4+����2c��SO42-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪���ٷ�Ӧ2C+O2=2CO �������仯��ͼ��ʾ���ں�5.6g KOH��ϡ��Һ��0.5L 0.1mol/L��H2SO4��Һ��Ӧ�ų�5.73kJ������������˵����ȷ���ǣ�������
��֪���ٷ�Ӧ2C+O2=2CO �������仯��ͼ��ʾ���ں�5.6g KOH��ϡ��Һ��0.5L 0.1mol/L��H2SO4��Һ��Ӧ�ų�5.73kJ������������˵����ȷ���ǣ�������| A��2mol C��s��������O2��g����Ӧ����CO2��g�����ų�����������221 kJ |
| B��12g C��s����һ����O2��g����Ӧ����14 g CO��g�����ų�������Ϊ110.5 kJ |
| C���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�2C��s��+O2��g��=2CO��g����H=-110.5 kJ/mol |
| D����ʾ�к��ȵ��Ȼ�ѧ����ʽ2KOH ��aq��+H2SO4 ��aq��=K2SO4��aq��+2H2O ��l����H=-114.6 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
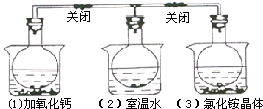 ��ͼ��ʾ��������ƿ�зֱ����NO2���壬���ֱ������ʢ���������ʵ��ձ��У��ձ�����ˮ�����ڣ�1���м���CaO���ڣ�2���в��������κ����ʣ��ڣ�3���м���NH4Cl���壬���֣�1���к���ɫ�����3���к���ɫ��dz������������ȷ���ǣ�������
��ͼ��ʾ��������ƿ�зֱ����NO2���壬���ֱ������ʢ���������ʵ��ձ��У��ձ�����ˮ�����ڣ�1���м���CaO���ڣ�2���в��������κ����ʣ��ڣ�3���м���NH4Cl���壬���֣�1���к���ɫ�����3���к���ɫ��dz������������ȷ���ǣ�������| A����ƿ��3���������ѹǿ���� |
| B��NH4Cl����ˮʱ�ų����� |
| C����ƿ��1����ƽ��ʱ��������ƽ����Է����������� |
| D��2NO2?N2O4�Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��A��g��+B��g��?C��g�� |
| B��A��g��+2B��g��?3C��g�� |
| C��A��g��+B��g��C��g��?D��g�� |
| D�����϶��ﵽƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
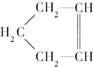 �ɼ�дΪ
�ɼ�дΪ ����Ƭϩ�ķ��ӽṹ�ɱ�ʾΪ��
����Ƭϩ�ķ��ӽṹ�ɱ�ʾΪ��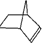
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��K+��H+��Cl-��SO42- |
| B��K+��Fe2+��NO3-��H+ |
| C��HCO3-��Na+��H+��NO3- |
| D��Na+��K+��CO32-��NO3- |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com