
下列叙述中正确的是 ( )
| A.明矾、硫酸铁都可以用于净水,但净水原理不同 |
| B.粗铝做阳极,硫酸铝溶液做电解液,电解精炼铝 |
| C.工业制硫酸中,将黄铁矿粉碎是为了提高黄铁矿的平衡转化率 |
| D.含有最高价元素的化合物,不一定有强氧化性 |
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol·L-1 |
| B.温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同 |
| C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是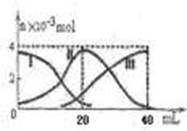
| A.当V(NaOH)=40mL时,c (Na+)+ c(H+)="2" c(A2-)+c(OH-) |
| B.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| C.滴加过程中当溶液呈中性时,V(NaOH)<20mL |
| D.HA-的电离程度小于水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是( )
| A.I和II中H2O的电离程度不相等 |
| B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH﹣)均减小 |
| C.I和II溶液混合,若c(OH﹣)>c(H+),则氢氧化钠一定过量 |
| D.I和II等体积混合后,溶液中离子浓度大小为c(CH3COO﹣)+ c(CH3COOH>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A.生成了一种强酸弱碱盐 | B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是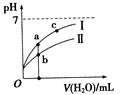
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c(C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列选项合理的是 ( )
A.pH皆等于3 的两种溶液都稀释100倍后,pH都为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH) 2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
| A.CaCO3的溶解度小于CaSO4 |
| B.沉淀转化的实质是沉淀溶解平衡的移动 |
| C.沉淀转化的难易与溶解度差别的大小无关 |
| D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com