
【题目】取过氧化氢(H2O2)样品10mL,加水配成250mL溶液,从中取出25mL,加稀硫酸酸化后,逐滴加入0.1mol·Lˉ1的KMnO4溶液。当反应完全时,消耗KMnO4溶液20.00mL。反应的方程式为:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O。请回答下列问题:
(1)所配制的250mL溶液中,H2O2的物质的量浓度是_____________。
(2)若原过氧化氢样品的密度为1.1 g·cm-3,则其溶质的质量分数为_______。
(3)滴入0.1 mol·Lˉ1KMnO4溶液反应完全后,反应中转移电子的数目为_______。
【答案】0.2 mol·Lˉ1 15.5%或15.45% 0.01NA
【解析】
(1)根据化学方程式,通过化学计量数之比等于参加反应的各物质的物质的量之比计算过氧化氢的物质的量,求出其物质的量浓度即为250mL溶液中H2O2的物质的量浓度;
(2)根据c=![]() 推导计算;
推导计算;
(3)根据氧化还原反应的规律分析作答。
(1)2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O,则2KMnO4~5H2O2,则反应的H2O2的物质的量为![]() =5
=5![]() 10-3 mol,则该溶液的浓度为
10-3 mol,则该溶液的浓度为![]() =0.2 mol·Lˉ1,故答案为:0.2 mol·Lˉ1;
=0.2 mol·Lˉ1,故答案为:0.2 mol·Lˉ1;
(2)根据第(1)问可知,原过氧化氢样品的浓度为0.2 mol·Lˉ1×250/10=5 mol·Lˉ1,因c=![]() ,若原过氧化氢样品的密度为1.1 g·cm-3,则其溶质的质量分数
,若原过氧化氢样品的密度为1.1 g·cm-3,则其溶质的质量分数![]() =
=![]() 15.5%或15.45%;
15.5%或15.45%;
(3)2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O反应中,KMnO4中Mn元素化合价从+7价降低到+2价,化合价降低5,因参加反应的KMnO4的物质的量为0.1 mol·Lˉ1 ![]() 0.02L=0.002mol,故转移电子数为
0.02L=0.002mol,故转移电子数为![]() =0.01NA。
=0.01NA。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾可以通过电解法进行制备,装置如图所示,下列说法错误的是
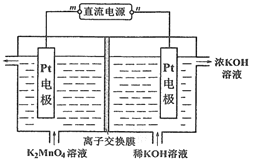
A. 阳极的电极反应式:MnO42- – e-= MnO4-
B. 该装置的离子交换膜为阳离子交换膜
C. 当电路通过a mol电子时,阴极室电解质溶液增加2a mol离子
D. 若电解流出液中KMnO4、K2MnO4和KOH物质的量之比为a∶b∶c,则流进电解池的电解液中K2MnO4和KOH的物质的量之比为 (a + b)∶( c + a )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol/L H2A溶液中存在H2A、HA和A2-三种形态的粒子,其物质的量分数δ(x)随溶液PH变化的关系如图所示[已知δ(x)=c(X)/(C(H2A)+ C(HA-)+C(A2-)),下列说法不正确的是(图中a=1.35、b=4.17)

A. PH=7的溶液中C(Na+)=2[(C(A2-)+C(HA-)+C(H2A)]
B. 0.lmol/LNaHA溶液中C(OH-)+C(A2-)=C(H+)+C(H2A)
C. 已知Pka=-1gKa,则Pka2=4.17
D. PH=3的溶液中C(HA-)>C(A2-)+C(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H可用于制备树脂、塑料和涂料等。其合成路线如下图所示:

已知:R—CH=CH2![]() RCH2CH2OH(其中B2H6为乙硼烷)
RCH2CH2OH(其中B2H6为乙硼烷)
请回答下列问题:
(1) 11.2 L(标准状况)的烃A在氧气中充分燃烧可以生成88 g CO2和45 g H2O。A的分子式是____________________。
(2)B和C在氢氧化钠的醇溶液中加热得到的有机物只有一种结构。B和C均为一氯代烃,它们的名称(系统命名)分别为_____________、_____________。
(3)在催化剂存在下1 mol F与2 mol H2反应,生成2甲基1丙醇。F的结构简式是_________________。其含有的官能团名称是_______________________。
(4)B→D,C→D的反应类型均为___________。请任写一个化学方程式_________________。
(5)写出F→G的化学方程式______________________________________________。
(6)写出E+G→H的化学方程式___________________________________________。
(7)写出与G具有相同官能团的G的所有同分异构体的结构简式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某酸(HA) 溶液中逐滴加入0.1mol/L的氨水,所得溶液的pH及导电能力与加入氨水的体积关系如图所示。下列说法中不正确的是

A. HA为弱酸
B. b点对应溶液pH=7,此时HA溶液与氨水恰好完全反应
C. c点对应的溶液存在c(OH-)=c(H+)+c(HA)
D. a、b、c三点中,b点对应的溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,科研人员应用计算机模拟出结构类似C60的物质N60,已知N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构。已知N—N键键能为159 kJ·mol-1,试回答下列问题:
(1)根据上述信息推测N60的结构特点:________________。
(2)1 mol N60分解成N2时吸收或放出的热量是____kJ。(已知N≡N的键能为946 kJ·mol-1)
(3)由(2)列举N60的一些用途:______________________________________。
(4)若N60分子中只含x个五边形和y个六边形,则x=________,y=____________。(已知:多面体中,棱边数=顶点数+面数-2)
(5)∠NNN=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com