
【题目】某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2:4:1:1,则M离子可能是下列中的( )
A.Na+B.OH-C.Mg2+D.Cl-
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.气体密度增大 D.氧气压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 使用催化剂是为了加快反应速率,提高原料的利用率
B. 燃烧一定都是放热反应
C. 燃烧必须要有氧气参与反应
D. 电解水和氢气在氧气中燃烧是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组大小顺序不正确的是
A. 酸性:H2SiO3﹤H3PO4﹤H2SO4 B. 热稳定性:H2Se﹤H2S﹤H2O
C. 还原性:HI﹥HBr﹥HCl D. 金属的还原性:Na﹤Mg﹤Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL 0.55mol/L 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
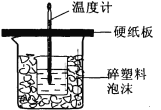
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是_________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用20 mL 0.50 mol/L的盐酸跟20mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是______________;所求中和热的数值会________(填“相等”或“不相等”),理由是_________________。若他测得Δt=3℃,则中和热ΔH为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
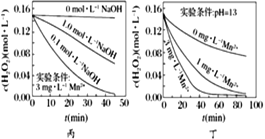
【题目】H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
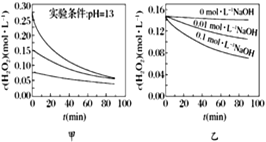
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ToC下,向体积为2 L的恒容密闭容器中通入NO2和O2,发生反应:4NO2(g)+O2(g)![]() 2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
时间/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s内NO2的平均反应速率为0.3 mol/(Ls)
B. 若10 s时,再向容器中充入2 mol N2O5(g),则新平衡下,NO2的体积分数将增大
C. 若5 s 时,改在绝热恒容下达平衡,新平衡下的平衡常数比原平衡的小
D. ToC,该反应的平衡常数为0.125,反应物的平衡转化率均为50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com