
【题目】某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL 0.55mol/L 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
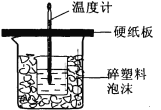
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是_________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用20 mL 0.50 mol/L的盐酸跟20mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是______________;所求中和热的数值会________(填“相等”或“不相等”),理由是_________________。若他测得Δt=3℃,则中和热ΔH为_______________
【答案】环形玻璃搅拌棒保温、隔热,减少实验过程中的热量损失偏小不相等因为酸、碱发生中和反应放出的热量与酸、碱的用量有关相等中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,它与酸、碱的用量无关-50.16kJ/mol
【解析】
(1).根据量热计的构造来判断该装置缺少的仪器;中和热测定实验成败的关键是保温工作;(2).不盖硬纸板,会有一部分热量散失;(3).反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来计算和解答。
(1).由量热计的构造可知该装置缺少的仪器是环形玻璃搅拌器;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,减少实验过程中的热量损失,故答案为:环形玻璃搅拌棒;保温、隔热,减少实验过程中的热量损失;
(2).大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3).反应放出的热量和所用酸以及碱的量的多少有关,若用20mL0.50mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量减少,放出的热量偏少,但中和热是指酸和碱发生中和反应生成1mol水时放出的热,与酸碱的用量无关,所以改用20mL0.50mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行上述实验,测得中和热数值相等;△H=-[40g×4.18×10-3kJ/(g ·℃)×3℃]÷0.01mol=-50.16kJ/mol,故答案为:不相等;因为酸、碱发生中和反应放出的热量与酸、碱的用量有关;相等;中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,它与酸、碱的用量无关;-50.16kJ/mol。


科目:高中化学 来源: 题型:
【题目】高一学生小强的化学笔记中有如下内容,你认为他的笔记中有几处错误( )
①依据水溶液能否导电将物质分为电解质与非电解质
②单质可分为金属单质和非金属单质
③化合物主要包括:酸、碱、盐和氧化物
④按照分散剂粒子直径大小可将分散系分为溶液、浊液和胶体
⑤溶液呈电中性,胶体带有电荷
A.二处B.三处C.四处D.五处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是( )
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C.恒温、恒容条件下,在工业合成氨反应中,增加氢气的量
D.在H2SO4与NaOH两溶液反应时,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2:4:1:1,则M离子可能是下列中的( )
A.Na+B.OH-C.Mg2+D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)现有反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K__ ___1(填“>”、“<”或“=”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x molH2,则:
①当x=5.0时,上述平衡向_______(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰)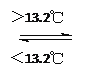 Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
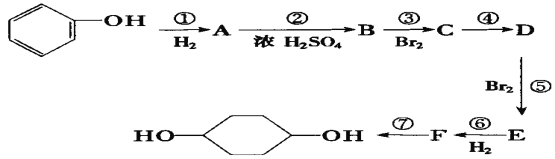
【题目】按以下步骤从![]() 合成
合成![]() 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是_______________。(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为______________________ 、_____________________、_____________________。
(4)写出下列反应的化学方程式(并注明反应条件) A→B _________;C→D____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据题意,完成下列各题:
(1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,表示乙醇的燃烧热的热化学方程式为__________________________________________________;
(2) “长征”2号火箭的发动机中用“偏二甲肼”(分子式为C2H8N2)和四氧化二氮作为液态燃料。已知a g偏二甲肼与b g四氧化二氮在发动机内燃烧生成稳定的、对环境友好的物质。若生成1 mol N2(g) 的反应热为c kJ,写出热化学方程式______________________________________________;
(3) T ℃时,如图所示, 对应的化学方程式为______________________;
(4) 向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1的HCl溶液,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=______________;
(5) 研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O==O | P==O |
键能kJ/mol | 197 | 360 | 499 | x |
已知白磷(P4)的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=_________________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,ΔS<0的是( )
A.氯化钠溶于水中
B.CaCO3(s)分解为CaO(s)和CO2(g)
C.干冰的升华
D.NH3(g)和HCl(g)反应生成NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com