
【题目】下列变化过程中,ΔS<0的是( )
A.氯化钠溶于水中
B.CaCO3(s)分解为CaO(s)和CO2(g)
C.干冰的升华
D.NH3(g)和HCl(g)反应生成NH4Cl
科目:高中化学 来源: 题型:
【题目】某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL 0.55mol/L 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
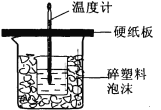
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是_________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用20 mL 0.50 mol/L的盐酸跟20mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是______________;所求中和热的数值会________(填“相等”或“不相等”),理由是_________________。若他测得Δt=3℃,则中和热ΔH为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电氟镁动力电池比锂电池具有更高的能量密度和安全性,在充电和放电时,其电池反应为Mg+2MnF3![]() 2MnF2+MgF2。下列说法不正确的是( )
2MnF2+MgF2。下列说法不正确的是( )
A. 放电时,镁为负极材料
B. 放电时,电子从镁极流出,经电解质流向正极
C. 充电时,阳极的电极反应式为:MnF2+F--e-=MnF3
D. 充电时,外加直流电源负极应与原电池的Mg极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ToC下,向体积为2 L的恒容密闭容器中通入NO2和O2,发生反应:4NO2(g)+O2(g)![]() 2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
时间/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s内NO2的平均反应速率为0.3 mol/(Ls)
B. 若10 s时,再向容器中充入2 mol N2O5(g),则新平衡下,NO2的体积分数将增大
C. 若5 s 时,改在绝热恒容下达平衡,新平衡下的平衡常数比原平衡的小
D. ToC,该反应的平衡常数为0.125,反应物的平衡转化率均为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
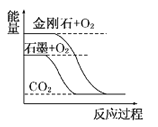

据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A. CH3OH(l)+3/2O2(g) ![]() CO2(g)+2H2O(l) ;ΔH=+725.8 kJ·mol-1
CO2(g)+2H2O(l) ;ΔH=+725.8 kJ·mol-1
B. 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ;ΔH=-1 452 kJ·mol-1
2CO2(g)+4H2O(l) ;ΔH=-1 452 kJ·mol-1
C. 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ;ΔH=-725.8 kJ·mol-1
2CO2(g)+4H2O(l) ;ΔH=-725.8 kJ·mol-1
D. 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ; ΔH=+1 452 kJ·mol-1
2CO2(g)+4H2O(l) ; ΔH=+1 452 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )

A.OH-由A端移向B端
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4 + 2O2 + KOH = KHCO3 + 2H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4 - 8e- + 9CO32- + 3H2O = 10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
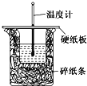
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,烧杯间填满碎泡沫塑料的作用是________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值__(填“偏大”、“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”),理由是_______________________________。
(4)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为2.3 ℃、2.4 ℃、2.9 ℃,则最终代入计算式的温度差的平均值为_____℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com