
【题目】如图所示,将铁棒和石墨棒插入1L1mol/L食盐水中。下列说法正确的是( )
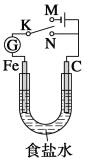
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28L(标准状况)气体时,生成了1.25molNaOH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素(以I形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃)
C.甘油(沸点290 ℃) D.苯(沸点80 ℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量________(填序号)溶液,反应的离子方程式___________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的“食品、矿产、能源、药物和水产资源”等,下列说法正确的是

A.第①步中除去泥沙及Ca2+、Mg2+等杂质时,不涉及化学变化过程
B.工业上,通过电解“精盐”水溶液可以制取金属钠
C.第②步的反应条件是“在空气中直接加热”
D.第③、④、⑤步中均涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2019 年第十届国际二次电池展中,一种以 Fe[Fe(CN)6]为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是
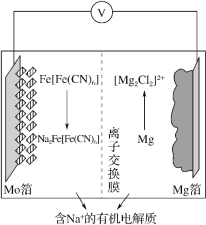
A.充电时,阴极反应式为 Fe[Fe(CN)6 ]+2Na++2e- =Na2Fe[Fe(CN)6 ]
B.充电时,Mg 箔接电源的正极
C.放电时,Na+通过离子交换膜从右室移向左室
D.放电时,外电路中通过 0.4mol 电子时,负极质量变化为 9.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中![]() 变化的曲线如图所示。
变化的曲线如图所示。
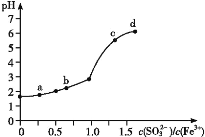
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
A.检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液
B.c点和d点出现上述现象的主要原因是Fe3+和![]() 发生双水解反应
发生双水解反应
C.b点较a点溶液pH升高的主要原因:2Fe3++![]() +H2O = 2Fe2++
+H2O = 2Fe2++![]() +2H+
+2H+
D.向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在建国70周年阅兵仪式上,“歼20”“东风-41 核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)查阅资料显示第二电离能 Cu 大于 Zn,理由是 _____________。
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为______,S的_____杂化轨道与O的2p轨道形成______键(填“π”或“σ”)。
(3)铁元素能与 CO 形成 Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为____。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为__(填字母序号)。
A.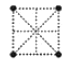 B.
B.  C.
C.  D .
D .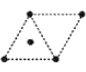
a. 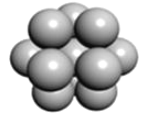 b.
b.  c.
c. 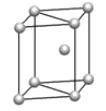
(5) 镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__;晶胞是图中的_(填 a、b 或 c);配位数是___;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ gcm-3,已知阿伏德罗常数为NA,则镁的摩尔质量的计算式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+2D(s)的下列反应速率,其中反应速率最大的是
2C(g)+2D(s)的下列反应速率,其中反应速率最大的是
A.v(D)=0.8molL-1s-1B.v(C)=0.010 molL-1s-1
C.v(B)=0.6 molL-1min-1D.v(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列离子方程式是否正确,错误的指明原因,并写出正确的离子方程式。____。
(1)铁粉溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑
(2)用三氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
(3)氢氧化铜溶于盐酸:OH-+H+=H2O
(4)氢氧化钡溶液与硫酸铜溶液混合:2OH-+Cu2+=Cu(OH)2↓
(5)铝与氯化铜溶液发生置换反应:Al+Cu2+=Al3++Cu
(6)硫酸溶液与氢氧化钡溶液混合:H++OH-+SO42-+Ba2+=BaSO4↓+H2O
(7)碳酸钙溶于硝酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
(8)碳酸氢钙溶液与足量氢氧化钠溶液混合HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使pH试纸变蓝的溶液中:![]() 、Na+、Cl-、ClO-
、Na+、Cl-、ClO-
B.1.0 mol·L-1的HNO3溶液中:K+、[Ag(NH3)2]+、Cl-、![]()
C.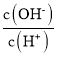 =1的溶液中:Fe2+、
=1的溶液中:Fe2+、![]() 、Al3+、I-
、Al3+、I-
D.0.1 mol·L-1的NH4HCO3溶液中:K+、Na+、![]() 、Cl-
、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com