
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“=”或“<”) ;
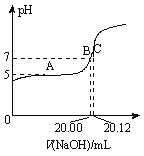
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________;
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________;
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________;
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________;
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”) ;
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
【答案】>2×10-50.1006 mol/LBD0.125 mol/(L·min)81>不变
【解析】
I.(1)相同温度下,酸的浓度越小其电离程度越大,所以pH=3醋酸的浓度大于pH=4醋酸浓度的10倍, 100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,,前者的物质的量大于后者,醋酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积 V1>V2;综上所述,本题答案是: >。
(2) A点所示溶液中c(CH3COO-)=2c(CH3COOH),此处pH=5,则c(H+)=10-5mol/L,CH3COOH的电离常数Ka= c(H+)×c(CH3COO-)/c(CH3COOH)= 10-5×2 c(CH3COOH)/c(CH3COOH)=2×10-5;C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+),此时消耗的氢氧化钠为20.12mL,则未知浓度的 CH3COOH溶液的实际浓度为0.1000×20.12/20=0.1006 mol/L ;综上所述,本题答案是: 2×10-5 ;0.1006 mol/L。
Ⅱ.(1) A.该反应为反应前后体积变化为0的反应,无论反应是否达到平衡状态,容器中压强始终不变,所以不能据此判断反应是否达到平衡状态,故A错误;
B.反应向右进行时,气体的质量增加,而容器的体积不变,所以当混合气体密度不变时,该反应达到平衡状态,故B正确;
C.无论反应是否达到平衡状态,都存在H-H键断裂同时形成2 mol H-O,所以不能据此判断反应是否达到平衡状态,故C错误;
D.H2的体积分数不变时,氢气的浓度保持不变,该反应达到平衡状态,故D正确;
综上所述,本题选BD。
(2)根据反应可知,有8克氢气参加反应,反应后气体质量增加64克,现第2 min时,气体质量增加8g, 则参加反应的氢气的质量为1克,物质的量=1/2=0.5mol,氢气的平均反应速率=0.5/2×2=0.125 mol/(L·min);综上所述,本题答案是:0.125 mol/(L·min) 。
(3) 某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,设氢气的物质的量为xmol、水蒸气的物质的量为ymol,则其平均摩尔质量(2x+18y)/(x+y)=14,x:y=1:3,同一容器其浓度之比为1:3,则该温度下的平衡常数K=(3/1)4=81;综上所述,本题答案是:81。
(4) 若降低温度,K值减小,说明平衡向逆反应方向移动,则正反应是吸热反应,则反应的ΔH> 0;综上所述,本题答案是:>。
(5)平衡常数不变,即c(H2O)/c(H2)不变, n(H2O)/n(H2) 不变, n(H2O)/[n(H2O)+n(H2)] 也不变,故水的体积分数不变; 综上所述,本题答案是:不变。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是______(填序号,下同)。
2SO3(g)达到平衡状态的是______(填序号,下同)。
(2)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_______。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是_______。(注:B,C,D均为无色物质)
II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)反应开始至2min,以气体Y表示的平均反应速率为________;
(2)该反应的化学方程式为___________;
(3)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅲ.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。则电池工作时负极的电极反应式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)![]() 2HI(g) △Hl=-9.48kJ/mol
2HI(g) △Hl=-9.48kJ/mol
②H2(g) +I2(?)![]() 2HI(g) △H2=+26.48kJ/mol
2HI(g) △H2=+26.48kJ/mol
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. lmol固态碘升华时将吸热35.96kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在密闭容器中充入1molSO2与2molNO2发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
(1)恒温恒容下,在反应平衡体系中再充入一定量SO2,则NO2的平衡转化率__________(填“增大”、“不变”或“减小”,下同);
(2)恒温恒压下,在反应平衡体系中再充入一定量SO2,则NO2的平衡浓度_________;
(3)恒容下,升高温度,上述反应的平衡常数K为_________;
(4)恒容下,降低温度,重新达到平衡时![]() _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )
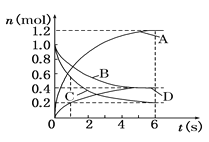
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的VL密闭容器中充入4molNH3和5molO2,发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)。请回答下列问题:
4NO(g)+6H2O(g)。请回答下列问题:
(1)下列能说明该反应已经达到平衡状态的是_______;
A .容器中气体总质量不变
B. c(O2)不变
C. υ(O2)=1.25υ(NH3)
D. 体系压强不变
E. 相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)已知上述反应达到平衡后,该反应各物质的浓度的定量关系称之为K,其表达式可表示为K =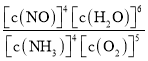 。如果达到平衡时,NH3的转化率为a,则K=_____(用含a的式子表示,数字采用指数形式)。
。如果达到平衡时,NH3的转化率为a,则K=_____(用含a的式子表示,数字采用指数形式)。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小。则速率逐渐增大是因为______,速率又逐渐减小的原因是_____。
(4)1mol NH3(g)在纯氧中完全燃烧生成无污染的气态物质,放出akJ的热量。写出该反应的热化学方程式_____。
(5)若将(4)所述反应设计为原电池,负极反应式 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
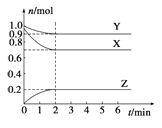
(1)该反应的化学方程式为_______________。
(2)反应开始至2min,气体Z的反应速率为_____________。
(3)若X、Y、Z均为气体,反应达平衡时:①压强是开始时的_______倍;②若此时将容器的体积缩小为原来的0.5倍,达平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为_________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,已知:NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl,其一种生产工艺如下。
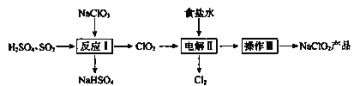
请回答下列问题:
(1)NaClO2中Cl元素的化合价为____________。
(2)反应I:
①SO2做___________(填“氧化剂”或“还原剂”)。
②写出反应I的化学方程式:__________________________。
(3)电解II:
①所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的Mg2+和Ca2+,需要加入的试剂分别为_______、______。
②电解过程中被氧化的物质是________。
③可用NaOH溶液吸收电解产生的Cl2,反应的离子方程式是______________。
(4)操作III:
滤液获利NaClO2的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com