
| A.1∶10∶100∶1000 | B.0∶1∶12∶11 |
| C.14∶13∶12∶11 | D.14∶13∶2∶3 |
科目:高中化学 来源:不详 题型:单选题
| A.由水电离出的c(H+)相等 |
| B.由水电离出的c(H+)都是1.0×10-12 mol·L-1 |
| C.由水电离出的c(OH-)都是0.01 mol·L-1 |
| D.两者都促进了水的电离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
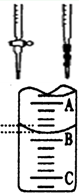
 (偏高、偏低或无影响)。
(偏高、偏低或无影响)。 管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2O的电子式为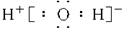 |
| B.4 ℃时,水的pH=7 |
| C.D216O中,质量数之和是质子数之和的两倍 |
| D.273 K、101 kPa,2.4L水所含分子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
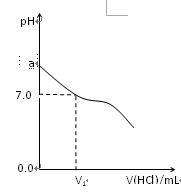
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=___ 。
2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=___ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。
液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。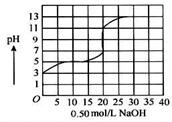
A.该弱酸在滴定前 的浓度是0.15 mol/L 的浓度是0.15 mol/L |
| B.该弱酸稀释10倍后pH为4 |
| C.滴定过程为求滴定终点,最合适的指示剂是酚酞 |
| D.滴定过程为求滴定终点,最合适的指示剂是甲基橙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com