
【题目】在xR2++yH++O2=mR3++nH2O的离子方程式中,对m和R3+的判断正确的是( )
A.m=2 R2+是还原剂B.m=y R3+是氧化产物
C.m=2 R2+是氧化剂D.m=y R3+是还原产物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列粒子(分子或离子)均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离子 | 化合物,双核分子 | 单质,双核分子 | 化合物,三核分子 | 化合物,四核分子 | |
请回答下列问题:
(1)A的元素符号是____________,B2-的结构示意图是________。
(2)C与D混合,发生反应的化学方程式为_____________________________________。
(3)E的电子式是________;F的水溶液常用于消毒剂,F的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

请回答下列问题:
(1)非诺洛芬中的含氧官能团为________________(填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为______________。
(3)在上述五步反应中,属于取代反应的是_______________(填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:_______________。
(5)根据已有知识并结合相关信息,写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]()
合成路线流程图第一步已给出,请补充完整。
 _________________________________________。
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是

A. 操作①中玻璃棒的作用是加快固体溶解速度
B. 操作②的操作名称是过滤
C. 操作③中盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验现象所得出的结论中,正确的是( )
A. 无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32-
B. 某物质焰色反应呈黄色,结论:该物质是钠盐
C. 无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3
D. 无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
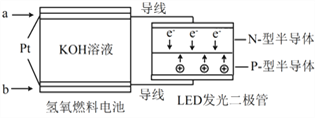
A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是造成大气污染的主要物质,现在工业上脱硝有多种方法。试回答下列问题
I.采用NaClO2溶液作为吸收剂可进行脱硝。反应一段时间后溶液中离子浓度的分析结果如下表:

写出NaClO2溶液和NO反应的脱硝过程中主要反应的离子方程式:______________________.
Ⅱ.用焦炭还原法将其转化为无污染的物质也可进行脱硝。已知:
2C(s)+O2(g)=2CO(g) △H1=-221.0kJ·mol-1;
N2(g)+O2(g)=2NO(g) △H2=+180.5kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2 (g) △H3=-746.0kJ /mol
回答下列问题
(1)用焦炭还原NO生成无污染气体的热化学方程式为______________________.
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mo/L)随时间(s)的变化如下表:(已知:三个容器的反应温度分别为T甲=400℃、T乙=400℃、T丙=a℃)

甲容器中,该反应的平衡常数K=_________丙容器的反应温度a__________400℃(填“>”,<”或“=”),理由是___________________________________.,用NH3催化还原NOx,也可以消除氮氧化物的污染。已知:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(l),ΔH<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示
7N2(g)+12H2O(l),ΔH<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示
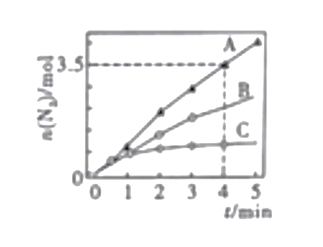
①在催化剂A的作用下0-4min的v(NO2)=___________________.
②该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是_____________,理由是_______________________________________.
③下列说法不正确的是____________(填序号)。
a.使用催化剂A达平衡时,△H值更大
b升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com