
【题目】下列离子方程式正确的是( )
A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 用氢氧化钠溶液吸收过量二氧化碳气体:CO2 +OH-=HCO3-
C. 制备氢氧化铁胶体:Fe3++3OH--Fe(OH)3↓
D. 醋酸除去水垢:2H+ +CaCO3=Ca2++CO2↑+H2O
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于 100 mL 稀硝酸中,产生 1.12 L NO气体(标准状况),向反应后的溶液中加入 NaOH 溶液,产生沉淀情况如图所示。下列说法不正确的是

A.可以求出合金中镁铝的物质的量比为 1∶1B.可以求出硝酸的物质的量浓度
C.可以求出沉淀的最大质量为 3.21 克D.氢氧化钠溶液浓度为 3 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为:C2H6+18OH--14e-=2CO![]() +12H2O。有关此电池的推断不正确的是( )
+12H2O。有关此电池的推断不正确的是( )
A.通入乙烷的电极为负极
B.放电一段时间后,KOH的物质的量浓度将下降
C.参加反应的O2与C2H6的质量比为32:105
D.溶液中的OH-向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同位素的是___(填写序号,下同),互为同素异形体的是__,互为同分异构体的是___,是同一种物质的是____,属于同系物的是__。
①H-O-C≡N与H-N=C=O
②CuSO4与CuSO45H2O
③H2O与D2O
④H、D与T
⑤O2与O3
⑥CH3CH2CH3与CH3CH2CH2CH3
⑦CH3CH2CHO与![]()
⑧CH3-CH2-CH=CH2与CH3-CH=CH-CH3
⑨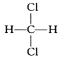 与
与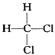
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用于简单有机化合物的制备、分离、提纯常见的简易装置。请根据该装置回答下列问题:

(1)若用C3H8O(醇)与乙酸反应生成酯类化合物,则在烧瓶A中加入C3H8O(醇)与乙酸外,还应加入的试剂是 ___________,试管B中应加入 ____________,饱和碳酸钠溶液虚线框中的导管作用是 ______________.
(2)分子式为C3H8O的有机物在一定条件下脱水生成的有机物可能有 ________种;
(3)若用该装置分离乙酸和1-丙醇,则在烧瓶A中加入1-丙醇与乙酸外,还应先加入适量的试剂 ____(填化学式),加热到一定温度,试管B中收集到的是(填写结构简式) _____,冷却后,再向烧瓶中加入试剂 ______ (填名称),再加热到一定温度,试管B中收集到的是 _____(填写分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为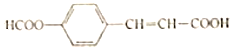 有关该化合物的叙述不正确的是( )
有关该化合物的叙述不正确的是( )
A.所有碳原子可能共平面
B.可以发生水解、加成和酯化反应
C.1mol该物质最多消耗2molNaOH
D.苯环上的二溴代物同分异构体数目为4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O = SO42+4H++2Fe2+,Cr2O72+6Fe2++14H+ = 2Cr3++6Fe3++7H2O。下列说法正确的是( )
A.还原性:Cr3+>Fe2+>SO2B.氧化性:Cr2O72>Fe3+>SO2
C.Cr2O72不能将SO2氧化D.两个反应中Fe2(SO4)3均作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(III)酸钾K3[Fe
(C
2O4)3]3H2O(其相对分子质量为491),为绿色晶体,易溶于水,难溶于酒精。110℃下可完全失去结晶水,230℃时分解。它还具有光敏性,光照下即发生分解,是制备活性铁催化剂的原料。某化学小组制备该晶体,并测定其中铁的含量,进行如下实验:
Ⅰ.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O42H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O42H2O晶体的化学方程式___。检验FeC2O42H2O晶体是否洗涤干净的方法是___。
(2)步骤②中检验Fe2+是否完全转化的操作为___。
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是___。
Ⅱ.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化,MnO4-被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+。
步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯____,___,___。
(5)写出步骤三中发生反应的离子方程式____。
(6)实验测得该晶体中铁的质量分数为____(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:K=![]() 。
。
(1)请写出该反应的化学方程式:___。
(2)恒温恒容条件下容器中气体的平均相对分子质量、气体的分子总数或混合气体的___不再随时间变化,都可说明该反应已达平衡状态。
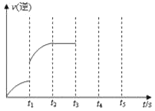
(3)该反应的逆反应速率随时间变化的关系如图,t1时的突变一定是因为某种条件的改变,该改变不可能是___;
a.减小H2浓度 b.使用催化剂 c.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com