
【题目】我国的“长三丙火箭”第三级推进器使用的燃料是液态氢。已知在25℃时,2gH2在O2中完全燃烧生成液态水时放出热量285.8kJ。下列有关说法中,正确的是( )
A.H2的燃烧热为–285.8kJ
B.2H2(g)+O2(g)=2H2O(l) ΔH=+571.6kJmol–1
C.25℃时,2H2(g)+O2(g)=2H2O(g)的ΔH>–571.6kJmol–1
D.25℃时,11.2LH2在O2中完全燃烧生成液态水时放出热量142.9kJ
【答案】C
【解析】
2g氢气物质的量为:![]() =1mol,1molH2在O2中完全燃烧生成液态水时放出热量285.8kJ,反应的热化学方程式为:H2(g)+
=1mol,1molH2在O2中完全燃烧生成液态水时放出热量285.8kJ,反应的热化学方程式为:H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1。
O2(g)=H2O(l)△H=-285.8kJmol-1。
A.根据分析可知氢气燃烧热为285.8kJmol-1,故A错误;
B.根据分析可知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJmol-1,故B错误;
C.2mol氢气燃烧生成液体水放出的热量为571.6kJ,液态水变为气态水吸热,所以生成气态水放出的热量更少,又因为放热反应焓变小于零,所以25℃时,2H2(g)+O2(g)=2H2O(g)的ΔH>–571.6kJmol–1,故C正确;
D.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2氢气的物质的量,故D错误;
故答案为C。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下表为部分一氯代烷的结构简式和沸点数据,下列对表中物质与数据的分析归纳,错误的是( )
物质代号 | 结构简式 | 沸点/℃ |
① |
|
|
② |
| 12.3 |
③ |
| 46.6 |
④ |
| 35.7 |
⑤ |
| 78.44 |
⑥ |
| 68.2 |
⑦ |
| 52 |
A.物质①②③⑤互为同系物
B.一氯代烷同分异构体的沸点随着支链的增多而升高
C.一氯代烷的沸点随着碳原子数的增多而升高
D.物质⑤与⑦互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,其晶体中阴离子的最小结构单元如图所示。它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,则下列说法正确的是( )
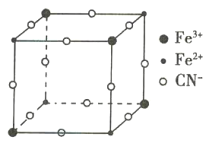
A.x=2,y=1
B.该晶体属于离子晶体,M呈+1价
C.M的离子不可能在立方体的体心位置
D.该晶胞中与每个Fe3+距离最近且相等的CN-有3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),随着矿石品位的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
Ⅰ.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有![]() 生成。
生成。
①该反应的离子方程式为____________________________________________。
②该反应在25~50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因:_____________________________________________________。
Ⅱ.配位浸出
反应原理为:![]() (未配平)
(未配平)
(2)为提高黄铜矿的浸出率,可采取的措施有____________________(至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4Cl,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向a mol·L-1的氨水中缓慢加入等体积0.02mol·L-1的NH4Cl溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb=________(用含a的代数式表示);滴加NH4Cl溶液的过程中水的电离平衡________(填“正向”“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
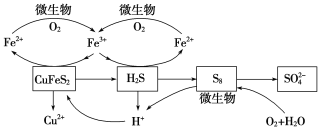
(4)在微生物的作用下,可以循环使用的物质有________(填化学式),微生物参与反应的离子方程式为______________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2mol ![]() 生成时,理论上消耗O2的物质的量为________。
生成时,理论上消耗O2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了在锂离子电池领域 作出贡献的三位科学家。他们于 1972年提出“摇椅式“电池 ( Rock ing chair battery), 1980年开发出 LiCoO2材料, 下图是该电池工作原理图,在充放电过程中, Li+在两极之间“摇来摇去”,该电池充电时的总反应为:LiCoO2+ 6C ( 石墨)=Li (1-x)CoO2+LixC6。下列有关说法正确的是
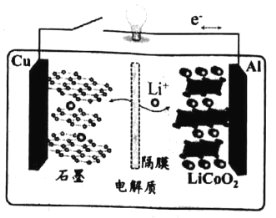
A.充电时,Cu 电极为阳极
B.充电时,Li+将嵌入石墨电极
C.放电时,Al 电极发生氧化反应
D.放电时,负极反应 LiCoO 2—xe-=Li (1-x)CoO2+ (1-x ) + xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的CO和NO在排放时会发生复杂的化学反应。回答下列问题:
(1)通过NO传感器可监测汽车排放尾气中NO含量, 其工作原理如图所示。
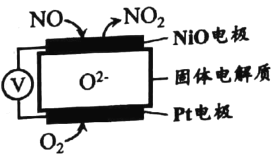
该传感器正极的电极反应式为 _________________。
(2)已知如下发生反应:
①2CO(g)+O2(g)=2CO2(g) △H1 =-606.6 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2= -114.1 kJ·mo l-1
则反应CO(g) +NO2(g) = CO2(g) +NO(g)的△H =__________kJmo l-1
(3)300K时,将等浓度的CO 和 NO2混合加入刚性密闭容器中,发生反应CO(g) +NO2(g) = CO2(g) +NO(g), 测得 c(CO)浓度随时间t 的变化如表所示。
t/min | 0 | 20 | 90 | 170 | 560 | 1600 | 13200 | 14000 | ∞ |
c(CO)/mol·L-1 | 0.100 | 0.075 | 0.055 | 0.047 | 0.034 | 0.025 | 0.013 | 0.013 | 0.013 |
①300K时反应的平衡转化率α=_______%。平衡常数K=_______(保留1 位小数)。
②在300K下: 要提高CO转化率, 可采取的措施是_____________;要缩短反应达到平衡的时间,可采取的措施有______________、____________________。
③实验测得:反应物浓度按任意比时,该反应的正反应速率均符合v正=k正c2(NO2)。其中:k正为正反应速率常数,是与平衡常数K类似的只受温度影响的常数。请推理出v逆的表达式:v逆=_____________ (用k正 、 K 与c(CO)、c(CO2 )、c(NO)表达)。
④根据v逆的表达式 ,一定温度下,当反应达平衡后, t1时刻增大CO浓度, 平衡发生移动,下列图像正确的是______________。
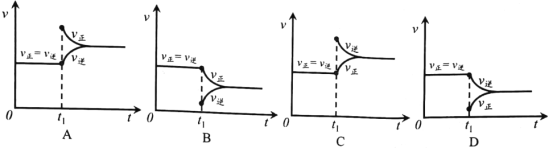
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家对“液流电池”的研究取得新进展,一种新型的高比能量锌-碘溴液流电池工作原理如下图所示。下列有关叙述错误的是
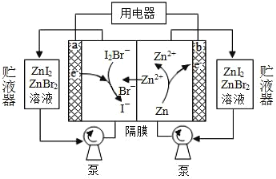
A.放电时,a 极电势高于 b 极
B.充电时,a 极电极反应为 I2Br-+2e-=2I-+Br-
C.图中贮液器可储存电解质溶液,提高电池的容量
D.导线中有 NA 个电子转移,就有 0.5 mol Zn2+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用甲苯生产一种常用的化妆品防霉剂,其生产过程如图所示(反应条件没有全部注明)。
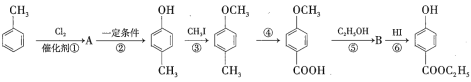
回答下列问题。
(1)有机物A的结构简式为___________________。
(2)在合成路线中,设计第③步反应的目的是________________________。
(3)写出反应⑤的化学方程式:_____________________________。
(4)请写出由![]() 生成
生成![]() 的化学反应方程式:_____________。
的化学反应方程式:_____________。
(5)下列有关说法正确的有____________(填序号)。

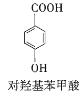
a.莽草酸、对羟基苯甲酸都属于芳香化合物
b.![]() 莽草酸与
莽草酸与![]() 溶液反应,最多消耗
溶液反应,最多消耗![]()
c.二者均可以发生酯化、加成等反应
d.利用![]() 溶液可区别莽草酸和对羟基苯甲酸
溶液可区别莽草酸和对羟基苯甲酸
(6)写出同时符合下列要求的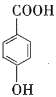 的所有同分异构体的结构简式:______。
的所有同分异构体的结构简式:______。
a.含苯环
b.可与![]() 溶液发生显色反应
溶液发生显色反应
c.一氯代物有两种
d.能发生银镜反应,不能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 分子中三种原子均以杂化轨道成键
分子中三种原子均以杂化轨道成键
B.![]() 的电子式为
的电子式为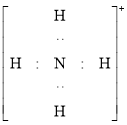 ,该离子呈平面正方形
,该离子呈平面正方形
C.![]() 分子中的4个
分子中的4个![]() 键都是由氢原子的
键都是由氢原子的![]() 轨道与碳原子的
轨道与碳原子的![]() 轨道重叠形成的
轨道重叠形成的
D.![]() 分子中碳原子的
分子中碳原子的![]() 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的![]() 轨道重叠,形成4个
轨道重叠,形成4个![]() 键
键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com