
【题目】我国产铜主要取自黄铜矿(CuFeS2),随着矿石品位的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
Ⅰ.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有![]() 生成。
生成。
①该反应的离子方程式为____________________________________________。
②该反应在25~50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因:_____________________________________________________。
Ⅱ.配位浸出
反应原理为:![]() (未配平)
(未配平)
(2)为提高黄铜矿的浸出率,可采取的措施有____________________(至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4Cl,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向a mol·L-1的氨水中缓慢加入等体积0.02mol·L-1的NH4Cl溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb=________(用含a的代数式表示);滴加NH4Cl溶液的过程中水的电离平衡________(填“正向”“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
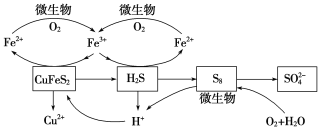
(4)在微生物的作用下,可以循环使用的物质有________(填化学式),微生物参与反应的离子方程式为______________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2mol ![]() 生成时,理论上消耗O2的物质的量为________。
生成时,理论上消耗O2的物质的量为________。
【答案】![]() H2O2受热分解;产物Cu2+、Fe3+催化H2O2分解等 提高氨水的浓度、提高氧压
H2O2受热分解;产物Cu2+、Fe3+催化H2O2分解等 提高氨水的浓度、提高氧压 ![]() 正向 Fe2(SO4)3,H2SO4
正向 Fe2(SO4)3,H2SO4  或
或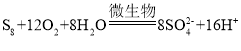 (任写一个) 4.25mol
(任写一个) 4.25mol
【解析】
(1)①CuFeS2中铜元素为+2价且为最高价态,铁元素为+2价,在酸性条件下能被双氧水氧化为Fe3+,S为-2价,可被氧化为SO42-,故反应的离子方程式为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
②过氧化氢受热分解,且生成的Cu2+、Fe3+可催化过氧化氢分解;
(2)由反应原理可知,为提高浸出率,可将黄铜矿粉碎、增大氨水浓度、增大氧压等;
(3)混合溶液中c(NH4+)=0.02/2=0.01mol/L,c(OH-)=10-7mol/L, ;滴加氯化铵溶液促进水的电离,水的电离平衡正向移动;
;滴加氯化铵溶液促进水的电离,水的电离平衡正向移动;
(4)由关系图可知,可以循环使用的物质为Fe2(SO4)3、H2SO4;由二价铁转化为三价铁有微生物参与,离子方程式为 ;S8与O2和H2O反应也有微生物参与,离子方程式为
;S8与O2和H2O反应也有微生物参与,离子方程式为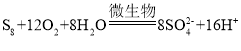 ;
;
(5)由题意知,当生成2mol SO42-时,有1mol Fe2+转化为Fe3+,Fe2+失去1mol电子,S2失去16mol电子,共失去17mol电子,则消耗氧气的物质的量为![]() ;
;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】L多巴胺是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下
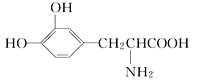
下列关于L多巴胺的叙述不正确的是( )
A. 它属于α氨基酸,既具有酸性,又具有碱性
B. 它遇到FeCl3溶液显紫色
C. 它可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环
D. 它既与酸反应又与碱反应,等物质的量的L多巴胺最多消耗NaOH与HCl的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有烃的含氧衍生物A(A分子中只有一种官能团),还原A时形成醇B,氧化A时形成酸C。由B、C反应可生成高分子化合物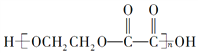 ,下列叙述中错误的是( )
,下列叙述中错误的是( )
A. A属于醛类,其相对分子质量为58,1 mol A与足量的银氨溶液反应可生成4 mol Ag
B. B在一定条件下可通过缩聚反应得到一种新的高聚物
C. 高分子化合物 的组成与B、C等物质的混合物的组成相同
的组成与B、C等物质的混合物的组成相同
D. B、C生成高聚物的反应为缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
19-Ⅰ
下列叙述正确的有_______。
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
19-Ⅱ
ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,原子间存在的共价键类型有________,碳原子的杂化轨道类型为__________________。



(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______、共价性_________。(填“增强”“不变”或“减弱”)
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:
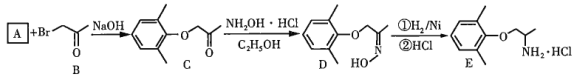
回答下列问题:
(1)已知A的分子式为![]() ,其化学名称为______。
,其化学名称为______。
(2)B中的官能团的名称为_________。
(3)由A生成C的化学反应方程式为________,反应类型是_________。
(4)由D的结构可判断:D应存在立体异构。该立体异构体的结构简式为______。
(5)若用更为廉价易得的氨水替代盐酸羟氨![]() 与C反应,生成物的结构简式为______。
与C反应,生成物的结构简式为______。
(6)A的同分异构体中能与三氯化铁溶液发生显色反应的还有__种;其中,核磁共振氢谱为四组峰,峰面积比为6∶2∶1∶1的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的“长三丙火箭”第三级推进器使用的燃料是液态氢。已知在25℃时,2gH2在O2中完全燃烧生成液态水时放出热量285.8kJ。下列有关说法中,正确的是( )
A.H2的燃烧热为–285.8kJ
B.2H2(g)+O2(g)=2H2O(l) ΔH=+571.6kJmol–1
C.25℃时,2H2(g)+O2(g)=2H2O(g)的ΔH>–571.6kJmol–1
D.25℃时,11.2LH2在O2中完全燃烧生成液态水时放出热量142.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H具有似龙延香、琥珀香气息,香气淡而持久,广泛用作香精的稀释剂和定香剂.合成它的一种路线如图:
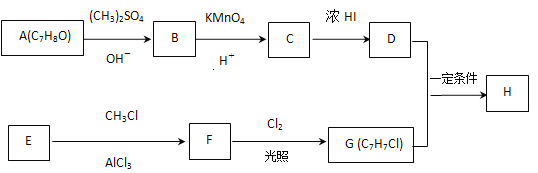
已知以信息:
①![]() ;
;
②核磁共振氢谱显示A的苯环上有四种化学环境不同的氢原子,且取代基的位置相邻;
③在D中滴加几滴FeCl3溶液,溶液呈紫色;
④芳香烃 F的相对分子质量介于90~100之间,0.1 mol F充分燃烧可生成7.2 g水;
⑤R1COOH+RCH2Cl![]() R1COOCH2R+HCl。
R1COOCH2R+HCl。
回答下列问题:
(1)A的化学名称是____,由C生成D的反应的化学方程式为______________。
(2)由F生成G的反应的化学方程式为____________,反应类型为____。
(3)H的结构简式为_________。
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体有 (不考虑立体异构)_____种,其中核磁共振氢谱中有5组峰,且峰面积之比为1∶2∶2∶2∶1的同分异构体的结构简式是________(任写一种即可)。
(5)由苯酚和已有的信息经以下步骤可以合成化合物
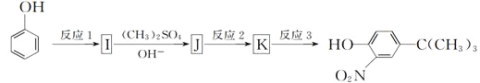
反应1所用的试剂为___,K的结构简式为____,反应3所用的试剂为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com