
【题目】盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:
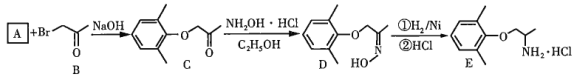
回答下列问题:
(1)已知A的分子式为![]() ,其化学名称为______。
,其化学名称为______。
(2)B中的官能团的名称为_________。
(3)由A生成C的化学反应方程式为________,反应类型是_________。
(4)由D的结构可判断:D应存在立体异构。该立体异构体的结构简式为______。
(5)若用更为廉价易得的氨水替代盐酸羟氨![]() 与C反应,生成物的结构简式为______。
与C反应,生成物的结构简式为______。
(6)A的同分异构体中能与三氯化铁溶液发生显色反应的还有__种;其中,核磁共振氢谱为四组峰,峰面积比为6∶2∶1∶1的结构简式为______。
【答案】2,![]() 二甲基苯酚 羰基、溴原子
二甲基苯酚 羰基、溴原子 ![]() 取代反应
取代反应 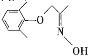
![]() 8
8 ![]()
【解析】
(1)A的分子式为C8H10O,对比B、C的结构,可知A为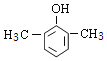 ;
;
(2)由B的结构,可知B中含有的官能团为-Br、![]() ;
;
(3)A与B发生取代反应生成C,还生成HBr,生成的HBr与NaOH发生中和反应;
(4)类似烯烃的顺反异构,羟基还可以与甲基处于双键的同一侧;
(5)氨水替代盐酸羟氨(NH2OHHCl)与C反应,相当于氨气与羰基之间脱去1分子水;
(6)A的同分异构体中能与三氯化铁溶液发生显色反应,说明含有酚羟基,2个甲基有邻、间、对三种位置,对应的酚羟基分别有2种、3种、1种(包含A),可以有2个取代基分别为酚羟基、乙基,有邻、间、对3种。
(1)根据B、C的结构简式以及A的分子式,可推断A为![]() ,母体为苯酚,甲基为侧链,其名称为2,
,母体为苯酚,甲基为侧链,其名称为2,![]() 二甲基苯酚,故答案为:2,
二甲基苯酚,故答案为:2,![]() 二甲基苯酚;
二甲基苯酚;
(2)B中官能团为-Br、-CO-,其名称为溴原子、羰基,故答案为:溴原子、羰基;
(3)A中酚羟基的H被![]() 取代生成C,同时生成HBr,HBr和NaOH反应生成NaBr和H2O,A和B反应生成C的方程式为:
取代生成C,同时生成HBr,HBr和NaOH反应生成NaBr和H2O,A和B反应生成C的方程式为:![]() ,故答案为:
,故答案为:![]() ;取代反应;
;取代反应;
(4)D中存在![]() 键,
键,![]() 和
和![]() 可以在
可以在![]() 键的同侧和两侧,故D的立体异构体为
键的同侧和两侧,故D的立体异构体为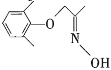 ,故答案为:
,故答案为: ;
;
(5)C与![]() 反应脱去1个水分子和1个HCl分子,若用NH3·H2O替代盐畯羟氨,则脱去两分子水,则生成物的结构简式为
反应脱去1个水分子和1个HCl分子,若用NH3·H2O替代盐畯羟氨,则脱去两分子水,则生成物的结构简式为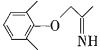 ,故答案为:
,故答案为:![]() ;
;
(6)A为![]() ,其同分异构体能与三氯化铁溶液发生显色反应,则属于酚,苯环上的取代基为①1个
,其同分异构体能与三氯化铁溶液发生显色反应,则属于酚,苯环上的取代基为①1个![]() 、1个
、1个![]() ,二者在苯环上有邻、间、对三种位置关系,共3种;②2个
,二者在苯环上有邻、间、对三种位置关系,共3种;②2个![]() 、1个
、1个![]() ,三者在苯环上共有6种位置关系,除去A物质本身,则其同分异构体共有8种。符合核磁共振氢谱有四组峰,峰面积比为6∶2∶1∶1的结构简式为
,三者在苯环上共有6种位置关系,除去A物质本身,则其同分异构体共有8种。符合核磁共振氢谱有四组峰,峰面积比为6∶2∶1∶1的结构简式为![]() ,故答案为:8;
,故答案为:8;![]() 。
。


科目:高中化学 来源: 题型:
【题目】几年前,央视《每周质量报告》曝光河北一些企业,用生石灰处理皮革废料,熬制成工业明胶,卖给绍兴新昌一些企业制成药用胶囊,国家相关部门得到消息后要求立即暂停购入和使用相关企业生产的所有胶囊剂药品。皮革废料发生水解后得到一种被称为脯氨酸( )的有机物,脯氨酸是人体所需的氨基酸之一,工业上可用α-氨基戊二酸合成,其合成路线如下:
)的有机物,脯氨酸是人体所需的氨基酸之一,工业上可用α-氨基戊二酸合成,其合成路线如下:

(1)α-氨基戊二酸中含有的官能团名称为_________。
(2)反应①的反应类型为_____________。
(3)反应![]() 可看作两步,其中间产物的分子式为
可看作两步,其中间产物的分子式为![]() ,且结构中含有五元环。写出由B反应生成中间产物的化学方程式:_________。
,且结构中含有五元环。写出由B反应生成中间产物的化学方程式:_________。
(4)合成路线中设计反应③、④的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.聚丙烯能使酸性高锰酸钾溶液褪色
B.聚乙烯是由分子组成的化合物,有固定的熔点
C.同质量的乙烯和聚乙烯燃烧后生成的![]() 的质量相等
的质量相等
D.高分子化合物的特点之一是组成元素简单、结构复杂、相对分子质量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式___________。
(2)AsCl3分子的立体构型为_________,其中As的杂化轨道类型为________。
(3)GaF3的熔点高于1000℃,GaCl2的熔点为77.9℃,其原因是______________。
(4)GaAs的熔点为1238℃,密度为ρ g/cm3,其晶胞结构如图所示。该晶体的类型为______________,Ga与As以______________键结合。Ga和As的摩尔质量分别为MGa g/mol和MAs g/mol,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),随着矿石品位的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
Ⅰ.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有![]() 生成。
生成。
①该反应的离子方程式为____________________________________________。
②该反应在25~50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因:_____________________________________________________。
Ⅱ.配位浸出
反应原理为:![]() (未配平)
(未配平)
(2)为提高黄铜矿的浸出率,可采取的措施有____________________(至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4Cl,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向a mol·L-1的氨水中缓慢加入等体积0.02mol·L-1的NH4Cl溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb=________(用含a的代数式表示);滴加NH4Cl溶液的过程中水的电离平衡________(填“正向”“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
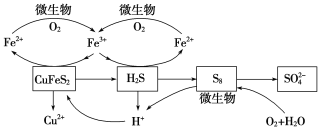
(4)在微生物的作用下,可以循环使用的物质有________(填化学式),微生物参与反应的离子方程式为______________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2mol ![]() 生成时,理论上消耗O2的物质的量为________。
生成时,理论上消耗O2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e-=Cd+2OH-
C.放电时电池内部OH-向负极移动
D.充电时与直流电源负极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的CO和NO在排放时会发生复杂的化学反应。回答下列问题:
(1)通过NO传感器可监测汽车排放尾气中NO含量, 其工作原理如图所示。
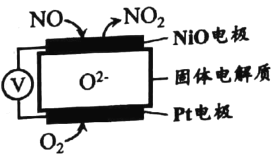
该传感器正极的电极反应式为 _________________。
(2)已知如下发生反应:
①2CO(g)+O2(g)=2CO2(g) △H1 =-606.6 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2= -114.1 kJ·mo l-1
则反应CO(g) +NO2(g) = CO2(g) +NO(g)的△H =__________kJmo l-1
(3)300K时,将等浓度的CO 和 NO2混合加入刚性密闭容器中,发生反应CO(g) +NO2(g) = CO2(g) +NO(g), 测得 c(CO)浓度随时间t 的变化如表所示。
t/min | 0 | 20 | 90 | 170 | 560 | 1600 | 13200 | 14000 | ∞ |
c(CO)/mol·L-1 | 0.100 | 0.075 | 0.055 | 0.047 | 0.034 | 0.025 | 0.013 | 0.013 | 0.013 |
①300K时反应的平衡转化率α=_______%。平衡常数K=_______(保留1 位小数)。
②在300K下: 要提高CO转化率, 可采取的措施是_____________;要缩短反应达到平衡的时间,可采取的措施有______________、____________________。
③实验测得:反应物浓度按任意比时,该反应的正反应速率均符合v正=k正c2(NO2)。其中:k正为正反应速率常数,是与平衡常数K类似的只受温度影响的常数。请推理出v逆的表达式:v逆=_____________ (用k正 、 K 与c(CO)、c(CO2 )、c(NO)表达)。
④根据v逆的表达式 ,一定温度下,当反应达平衡后, t1时刻增大CO浓度, 平衡发生移动,下列图像正确的是______________。
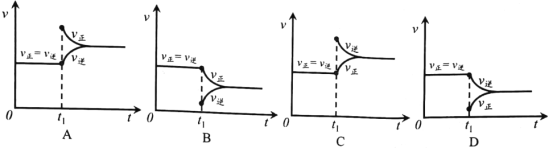
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】庆祝新中国成立 70 周年阅兵式上,“东风-41 洲际弹道导弹”“歼 20”等护国重器闪耀亮相,它们都采用了大量合金材料。
回答下列问题:
(1)某些导弹的外壳是以碳纤维为增强体,金属钛为基体的复合材料。基态钛原子的外围电子排布式为_____。钛可与 C、N、O 等元素形成二元化合物,C、N、O 元素的电负性由大到小的顺序是_________。
(2)钛比钢轻,比铝硬,钛硬度比铝大的原因是_____。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为_____,S 的_____杂化轨道与 O 的 2p 轨道形成_____键(填 “π”或“σ”)。
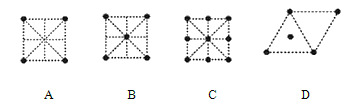
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为_____(填字母序号)。
(5)氮化钛熔点高,硬度大,其晶胞结构如图所示。
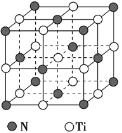
若氮化钛晶体中 Ti 原子的半径为 a pm,N 原子的半径为 b pm,则氮化钛晶体中原子的空间利用率的计算式为_____(用含 a、b 的式子表示)。碳氮化钛化合物在航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)光谱证实单质铝与强碱性溶液反应有![]() 生成,则
生成,则![]() 中存在__________(填序号)
中存在__________(填序号)
a.共价键 b.非极性键 c.配位键 d.![]() 键 e.π键
键 e.π键
(2)![]() 可形成两种钴的配合物,已知
可形成两种钴的配合物,已知![]() 的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加
的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加![]() 溶液时,产生白色沉淀,在第二种配合物的溶液中加
溶液时,产生白色沉淀,在第二种配合物的溶液中加![]() 溶液时,则无明显现象。则第一种配合物的结构可表示为____________________,第二种配合物的结构可表示为____________________。若在第二种配合物的溶液中滴加
溶液时,则无明显现象。则第一种配合物的结构可表示为____________________,第二种配合物的结构可表示为____________________。若在第二种配合物的溶液中滴加![]() 溶液,则产生的现象是____________________。(提示:
溶液,则产生的现象是____________________。(提示:![]() 这种配合物的结构可表示为
这种配合物的结构可表示为![]() 。)
。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com