
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式___________。
(2)AsCl3分子的立体构型为_________,其中As的杂化轨道类型为________。
(3)GaF3的熔点高于1000℃,GaCl2的熔点为77.9℃,其原因是______________。
(4)GaAs的熔点为1238℃,密度为ρ g/cm3,其晶胞结构如图所示。该晶体的类型为______________,Ga与As以______________键结合。Ga和As的摩尔质量分别为MGa g/mol和MAs g/mol,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______________。

【答案】[Ar]3d104s24p3 三角锥形 sp3 GaF3为离子晶体,GaCl3为分子晶体 原子晶体 共价 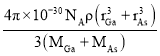 ×100%
×100%
【解析】
(1)As是33 号元素,原子核外有33个电子,根据构造原理书写As原子核外电子排布式为[Ar]3d104s24p3;
(2)AsCl3分子中As原子价层电子对个数=3+![]() =4,且含有一个孤电子对,根据价层电子对互斥理论可知该分子的立体构型为三角锥形,As原子杂化方式为sp3杂化;
=4,且含有一个孤电子对,根据价层电子对互斥理论可知该分子的立体构型为三角锥形,As原子杂化方式为sp3杂化;
(3)离子晶体熔沸点较高、分子晶体熔沸点较低,GaF3的熔点高,说明其为离子晶体,GaCl3的熔点为77.9℃,比较低,则GaCl3为分子晶体,所以前者沸点高于后者;
(4)GaAs的熔点为1238℃,熔点较高,原子之间以共价键结合形成属于原子晶体;密度为ρg/cm3,根据均摊法计算,As:8×![]() +6×
+6×![]() =4;Ga:4×1=4,故其晶胞中原子所占的体积V1=(
=4;Ga:4×1=4,故其晶胞中原子所占的体积V1=(![]() )×10-30 cm3,晶胞的体积V2=
)×10-30 cm3,晶胞的体积V2=![]() cm3,故GaAs晶胞中原子的体积占晶胞体积的百分率为
cm3,故GaAs晶胞中原子的体积占晶胞体积的百分率为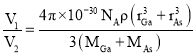 ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】试用相关知识回答下列问题:
(1)有机物大多难溶于水,而乙醇和乙酸可与水互溶,原因是_______。
(2)乙醚(![]() )的相对分子质量大于乙醇,但乙醇的沸点却比乙醚的高得多,原因是_________________。
)的相对分子质量大于乙醇,但乙醇的沸点却比乙醚的高得多,原因是_________________。
(3)从氨合成塔里分离出NH3,通常采用的方法是_____________,原因是_____________。
(4)水在常温下的组成的化学式可用(H2O)n表示,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质为3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:

已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是___。操作Ⅰ的名称是___。
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____。
(3)将pH控制在3.6的目的是___。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=___。
Cu(OH)2+2H+的平衡常数K=___。
(4)加入双氧水时反应的离子方程式为___。
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1kg,写出该反应完整的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C2H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醚等有机溶剂。下列说法不正确的是( )
A.二茂铁属于分子晶体
B.在二茂铁中,C5H5-与Fe2+之间形成的化学键类型是离子键
C.已知环戊二烯的结构式为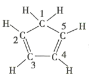 ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D. C5H5-中一定含有![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
19-Ⅰ
下列叙述正确的有_______。
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
19-Ⅱ
ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,原子间存在的共价键类型有________,碳原子的杂化轨道类型为__________________。



(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______、共价性_________。(填“增强”“不变”或“减弱”)
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖发酵可制得乳酸,从酸牛奶中也能提取出乳酸,纯净的乳酸为无色黏稠液体,易溶于水。为了研究乳酸的分子组成和结构,进行如下实验:
(1)称取乳酸![]() ,在某种状况下使其完全汽化,若相同状况下等体积氢气的质量为
,在某种状况下使其完全汽化,若相同状况下等体积氢气的质量为![]() ,则乳酸的相对分子质量为_______。
,则乳酸的相对分子质量为_______。
(2)若将上述乳酸蒸气在![]() 中燃烧只生成
中燃烧只生成![]() 和
和![]() ,当气体全部被碱石灰吸收后,碱石灰的质量增加
,当气体全部被碱石灰吸收后,碱石灰的质量增加![]() ;若将此气体通过足量的石灰水,产生
;若将此气体通过足量的石灰水,产生![]() 白色沉淀。则乳酸的分子式为________。
白色沉淀。则乳酸的分子式为________。
(3)乳酸分子能发生自身酯化反应,且其催化氧化产物不能发生银镜反应。若葡萄糖发酵只生成乳酸,试写出该反应的化学方程式:_______(忽略反应条件)。
(4)写出乳酸在催化剂作用下发生反应生成分子式为![]() 的环状酯的结构简式:__。
的环状酯的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:
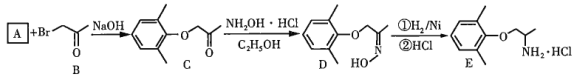
回答下列问题:
(1)已知A的分子式为![]() ,其化学名称为______。
,其化学名称为______。
(2)B中的官能团的名称为_________。
(3)由A生成C的化学反应方程式为________,反应类型是_________。
(4)由D的结构可判断:D应存在立体异构。该立体异构体的结构简式为______。
(5)若用更为廉价易得的氨水替代盐酸羟氨![]() 与C反应,生成物的结构简式为______。
与C反应,生成物的结构简式为______。
(6)A的同分异构体中能与三氯化铁溶液发生显色反应的还有__种;其中,核磁共振氢谱为四组峰,峰面积比为6∶2∶1∶1的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种抗疟疾药物, 研究发现,该药在细胞水平上能有效抑制新型冠状病毒的感染。其合成路线如下:
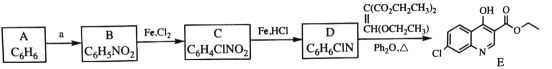

已知:

回答下列问题:
(1)A是一种芳香经, B 中官能团的名称为__________________。
(2)反应 A→B 中须加入的试剂a 为___________________。
(3)B 反应生成 C 的反应化学反应方程式是______________________。
(4)C→D 反应类型是_________, D的结构简式为_______________。
(5)F→G反应类型为________________。
(6)I是E的同分异构体,与E 具有相同的环状结构, 写出任意一种符合下列条件的I的结构简式是__________________________。
①I是三取代的环状有机物, 氯原子和羟基的取代位置与E相同;
②核磁共振氢谱显示I 除了环状结构上的氢外,还有4组峰, 峰面积比3:1:1:1;
③I加入NaHCO3溶液产生气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A有下列变化:
的有机物A有下列变化:

其中B、C的相对分子质量相等,下列有关说法错误的是( )
A.C和E互为同系物
B.符合题目条件的A共有4种
C.D既能发生氧化反应,又能发生还原反应
D.符合题目条件的B共有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com