
����Ŀ�������Ƿ��Ϳ��Ƶ����ᣬ����ţ����Ҳ����ȡ�����ᣬ����������Ϊ��ɫ��Һ�壬������ˮ��Ϊ���о�����ķ�����ɺͽṹ����������ʵ�飺
��1����ȡ����![]() ����ij��״����ʹ����ȫ����������ͬ״���µ��������������Ϊ
����ij��״����ʹ����ȫ����������ͬ״���µ��������������Ϊ![]() �����������Է�������Ϊ_______��
�����������Է�������Ϊ_______��
��2��������������������![]() ��ȼ��ֻ����
��ȼ��ֻ����![]() ��
��![]() ��������ȫ������ʯ�����պ�ʯ�ҵ���������
��������ȫ������ʯ�����պ�ʯ�ҵ���������![]() ������������ͨ��������ʯ��ˮ������
������������ͨ��������ʯ��ˮ������![]() ��ɫ������������ķ���ʽΪ________��
��ɫ������������ķ���ʽΪ________��
��3����������ܷ�������������Ӧ��������������ﲻ�ܷ���������Ӧ���������Ƿ���ֻ�������ᣬ��д���÷�Ӧ�Ļ�ѧ����ʽ��_______�����Է�Ӧ��������
��4��д�������ڴ��������·�����Ӧ���ɷ���ʽΪ![]() �Ļ�״���Ľṹ��ʽ��__��
�Ļ�״���Ľṹ��ʽ��__��
���𰸡�90 ![]()
![]()
��������
(1)��̬��������ʵ���=![]() �����������ʵ���=
�����������ʵ���=![]() ��ͬ��ͬѹ�£���ͬ������������ʵ�����ȣ����ԣ�
��ͬ��ͬѹ�£���ͬ������������ʵ�����ȣ����ԣ�![]() =
=![]() ���ɵ�
���ɵ�![]() ��
��
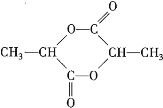
��1���ɷ�����֪����������֮���У�![]() ����
����![]() ����
����![]() �����������Է�������Ϊ90���ʴ�Ϊ��90��
�����������Է�������Ϊ90���ʴ�Ϊ��90��
��2��![]() ������ȫȼ������
������ȫȼ������![]() ������
������![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]() ������1�������������3��̼ԭ�Ӻ�6��Hԭ�ӣ���������Է�������Ϊ90����������ԭ����Ϊ
������1�������������3��̼ԭ�Ӻ�6��Hԭ�ӣ���������Է�������Ϊ90����������ԭ����Ϊ![]() ����������ķ���ʽΪ
����������ķ���ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��3����������ܷ�������������Ӧ��˵��������Ӽ���-COOH������-OH�����������ﲻ�ܷ���������Ӧ����-COOH��-OH��ͬһ��C������������Ľṹ��ʽΪ![]() ������ԭ���غ㣬��д�������Ƿ��͵ķ���ʽΪ��
������ԭ���غ㣬��д�������Ƿ��͵ķ���ʽΪ�� ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��4��������ӵ�-COOH��-OH���Է���������Ӧ���ɻ���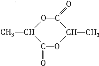 ���ʴ�Ϊ��
���ʴ�Ϊ��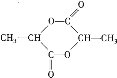 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���������ʳƷ��ҩ����ϵ������ž������ص����á�����˵����ȷ���ǣ� ��
A.�ױ��ͼ���ױ���һ��������4��
B.��ϵͳ��������������(CH3)2C(OH)C(CH3)3������Ϊ2��2��3-����-3-����
C.2-��ϩ�����е��ĸ�̼ԭ����ͬһֱ����
D.������������ں˴Ź���������ֻ�ܳ���һ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼��������Ⱦ����������β���ŷŴ���װ������������װ�á�
��1��ͨ����������������CO��NO�ڴ������������¿ɷ������淴Ӧ��ת��Ϊ�������ѭ������������壬д���÷�Ӧ�Ļ�ѧ����ʽ��__��
��2����һ���¶��£���1L�ܱպ��������г���1molNO��2molCO������������Ӧ��10sʱ��Ӧ�ﵽƽ�⣬��ʱCO�����ʵ���Ϊ1.2mol����ش��������⣺
��ǰ10s��ƽ����Ӧ����v(CO)=___��
���ڸ��¶��·�Ӧ��ƽ�ⳣ��K=___��
�۹���������Ӧ������������ȷ����___(����ĸ)��
A.�ﵽƽ��ʱ�����߲���CO2��ƽ�⽫�����ƶ�������Ӧ���ʼӿ�
B.���������������ƽ�⽫�����ƶ�
C.����ͬ�������£���ʹ�ü״�����ʹ����Ӧ���ʼӿ�105����ʹ���Ҵ�����ʹ�淴Ӧ���ʼӿ�108������Ӧ��ѡ���Ҵ���
D.������ƽ��ʱ���¶Ȳ��䣬���������г���0.8molCO��0.4molN2�����ʱv��>v��
����֪����ʵ���У�c(CO)�뷴Ӧʱ��t�仯���ߢ���ͼ��

�������������䣬��1molNO��2molCOͶ��2L�������з�Ӧ������ͼ�л��c(CO)�뷴Ӧʱ��t1�仯���ߢ�___(��Ҫ����CO���յ�����)��
��3������ij����������ʱ��β����������CO��NO�ٷֺ�����ʱ��仯������ͼ��

��ش�
ǰ0��10s�Σ�CO��NO�ٷֺ���û���Ա仯��ԭ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�غ͵����ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1��Ԫ��K����ɫ��Ӧ���Ϻ�ɫ��������ɫ��Ӧ�ķ��䲨��Ϊ_______nm�����ţ���
A��404.4 B��553.5 C��589.2 D��670.8 E.766.5
��2����̬Kԭ���У��������ռ�ݵ�����ܲ�ķ�����_________��ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ___________��K��Cr����ͬһ���ڣ��Һ����������ӹ�����ͬ��������K���۵㡢�е�ȶ��Ƚ���Cr�ͣ�ԭ����___________________________��
��3��X��������ⶨ�ȷ��֣�I3AsF6�д���I3+���ӡ�I3+���ӵļ��ι���Ϊ_____________������ԭ�ӵ��ӻ���ʽΪ________________��
��4��KIO3������һ���������õķ����Թ�ѧ���ϣ����и��ѿ��͵�����ṹ���߳�Ϊa=0.446nm��������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã���ͼ��ʾ��K��O�����̾���Ϊ______nm����K���ڵ�O����Ϊ__________��
��5����KIO3�����ṹ����һ�ֱ�ʾ�У�I���ڸ�����λ�ã���K����______λ�ã�O����______λ�á�
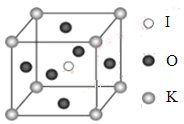
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���黯��(GaAs)�������İ뵼����ϣ������������ͼ�������̫���ܵ�صIJ��ϵȡ��ش��������⣺
(1)д����̬Asԭ�ӵĺ�������Ų�ʽ___________��
(2)AsCl3���ӵ����幹��Ϊ_________������As���ӻ��������Ϊ________��
(3)GaF3���۵����1000�棬GaCl2���۵�Ϊ77.9�棬��ԭ����______________��
(4)GaAs���۵�Ϊ1238�棬�ܶ�Ϊ�� g/cm3���侧���ṹ��ͼ��ʾ���þ��������Ϊ______________��Ga��As��______________����ϡ�Ga��As��Ħ�������ֱ�ΪMGa g/mol��MAs g/mol��ԭ�Ӱ뾶�ֱ�ΪrGa pm��rAs pm�������ӵ�����ֵΪNA����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ոѣ������������ʣ����ۺ����þ�����Ҫ�����塣�������Խո�Ϊԭ�Ϻϳɾ�����߷��ӻ������·�ߣ�
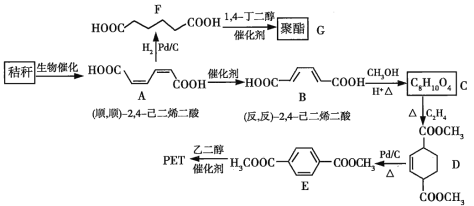
�ش��������⣺
��1�����й��������˵����ȷ����_________�������ţ�
a �������ζ������![]() ��ͨʽ b ��ѿ��ˮ�����ɻ�Ϊͬ���칹��������Ǻ���
��ͨʽ b ��ѿ��ˮ�����ɻ�Ϊͬ���칹��������Ǻ���
c ��������Ӧ�����жϵ���ˮ���Ƿ���ȫ d ���ۺ���ά�ض����ڶ�������Ȼ�߷��ӻ�����
��2��B����C�ķ�Ӧ����Ϊ___________��
��3��D�еĹ���������Ϊ_________��D����E�ķ�Ӧ����Ϊ_________��
��4��F�Ļ�ѧ������________��
��5������һ�ֹ����ŵĶ�ȡ�����㻯����W��E��ͬ���칹�壬![]() ������̼��������Һ��Ӧ����
������̼��������Һ��Ӧ����![]() ��W����_____�֣����������칹�������к˴Ź�������Ϊ�����Ľṹ��ʽΪ______��
��W����_____�֣����������칹�������к˴Ź�������Ϊ�����Ľṹ��ʽΪ______��
��6�����������ϳ�·�ߣ��ԣ���������![]() ��
��![]() �Ѷ�ϩ��
�Ѷ�ϩ��![]() Ϊԭ�ϣ����Լ���ѡ��������Ʊ��Ա�������ĺϳ�·��______��
Ϊԭ�ϣ����Լ���ѡ��������Ʊ��Ա�������ĺϳ�·��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�����������ҺΪKOH��Һ����ط�ӦΪ��Cd+2NiO(OH��+2H2O![]() Cd(OH)2+2Ni(OH)2�������й����ӵ�ص�˵����ȷ���ǣ� ��
Cd(OH)2+2Ni(OH)2�������й����ӵ�ص�˵����ȷ���ǣ� ��
A.�������ǻ�ѧ��ת��Ϊ���ܵĹ���
B.���ʱ������ӦΪCd(OH)2+2e-=Cd+2OH-
C.�ŵ�ʱ����ڲ�OH-���ƶ�
D.���ʱ��ֱ����Դ���������ĵ缫�Ϸ���Ni(OH)2ת��ΪNiO(OH)�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2molSO2��1molO2�����������ɱ䣬ѹǿ�㶨���ܱ������У���һ���¶��·������·�Ӧ��2SO2��g��+O2��g��![]() 2SO3��g������H��0������Ӧ���е�ʱ��t1��ʱ�ﵽƽ��״̬����û�����������ʵ���Ϊ2.1mol���Իش��������⣺
2SO3��g������H��0������Ӧ���е�ʱ��t1��ʱ�ﵽƽ��״̬����û�����������ʵ���Ϊ2.1mol���Իش��������⣺
��1����Ӧ���е�t1ʱ��SO2���������Ϊ__��
��2������t1ʱ����һ�����������Ar����SO2�����ʵ�����__������������������С����������������
��3������t1ʱ���£����´ﵽƽ��״̬����ƽ������������������ʵ���_2.1mol����������������������=��������˵��ԭ��__��
��4����t1�ﵽƽ�����������������ٱ仯���ټ���0.2molSO2��0.1molO2��1.8molSO3����ʱv��_v��(��������������������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���г�ҩ�������������ڶԿ� H1N1�����з����ش����ã�����Ч�ɷ���ԭ��Ľṹ��ʽ��ͼ�������й�˵���������

A. ��ԭ�����ڷ����廯����
B. ������������ 7 ��̼ԭ�ӹ���
C. 1mol ��ԭ���������� 5mol NaOH
D. ����ԭ�ᱽ����ȡ�������༰��������ͬ���л�����5 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com