
【题目】I.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
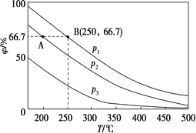
①其中,p1、p2 和p3 由大到小的顺序是____________,该反应ΔH _______0(填“>”“<”或“=”)。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为_______Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
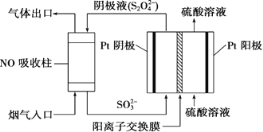
(3)①阴极区的电极反应式为___________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
Ⅳ.(4)常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________(用含a和b的代数式表示)。
【答案】高温 +247.1 p1>p2>p3 < < 8.3×103 2SO32-+4H++2e-=S2O42-+2H2O 1344 ![]()
【解析】
I.(1)反应自发进行的条件是△H-T△S<0,
水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+205.9kJmol-1①
CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1②
二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g)△H3③
盖斯定律计算①-②得到反应③的热化学方程式;
Ⅱ.(2)①由方程式N2+3H22NH3可知,增大压强,平衡正向移动,氨的体积分数越大;
②温度越大,压强越大,反应速率越大;
③用三段式解,设转化的氮气的物质的量为x:

![]() =0.667,x=0.08。平衡分压=总压×气体物质的量分数;
=0.667,x=0.08。平衡分压=总压×气体物质的量分数;
(3)①阴极区失去电子生成S2O42-;
②结合NO~NH4+~5 e-计算。
Ⅳ.(4)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算.
I.(1)水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①,△H>0,△S>0,满足△HT△S<0,则需要高温。
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①,△H>0,△S>0,满足△HT△S<0,则需要高温。
水蒸气重整CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3③
2CO(g)+2H2(g) ΔH3③
盖斯定律计算①-②得到反应③的热化学方程式CH4(g)+CO2(g)2CO(g)+2H2(g)△H3=+247.1KJ/mol,
故答案为:高温;+247.1;
II.(2)①由N2+3H22NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为p1>p2>p3,因此压强关系是p1>p2>p3,压强相同时,升高温度平衡逆向移动,故温度越高平衡混合物中氨的体积分数越小,故反应热小于零,
故答案为:p1>p2>p3;<;
②温度越,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,
故答案为:<;
③③用三段式解,设转化的氮气的物质的量为x:

![]() =0.667,x=0.08。
=0.667,x=0.08。
若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)=![]() =8.3×103,
=8.3×103,
故答案为:8.3×103;
III.(3)①由图可知,阴极区通入液体主要含SO32,流出液主要含S2O42,所以阴极区电极反应式为SO32-+4H++2e-=S2O42-+2H2O,
故答案为:SO32-+4H++2e-=S2O42-+2H2O;
②由于NO吸收转化后的主要产物为NH4+,NONH4+5e,若电路中转移0.3mole,消耗NO0.06mol,标准状况下体积为=0.06mol×22.4L/mol=1.344L=1344mL,
故答案为:1344。
Ⅳ. (4)反应平衡时,2c(Ba2+)=c(CH3COO)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH)=107mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K= ![]() =
=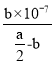 =
= ![]() ;
;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为![]() ,
,
故答案为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( )
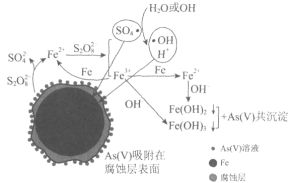
A.1mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56gFe参加反应,共有NA个S2O82-被还原
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为2.7×10-18mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的化工原料,用途很广。
![]() 合成氨工厂常用醋酸二氨合铜
合成氨工厂常用醋酸二氨合铜![]() 由
由![]() 和
和![]() 构成
构成![]() 溶液吸收对氨合成催化剂有毒害的CO气体。
溶液吸收对氨合成催化剂有毒害的CO气体。
![]() 醋酸二氨合铜所含的元素中,第一电离能最大的是 ______
醋酸二氨合铜所含的元素中,第一电离能最大的是 ______ ![]() 填元素名称
填元素名称![]() 。
。
![]() 醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______
醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______ ![]() 填标号
填标号![]() 。
。
![]() 离子晶体
离子晶体![]() 分子晶体
分子晶体![]() 原子晶体
原子晶体![]() 金属晶体
金属晶体
![]() 第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种
第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种![]() 不含
不含![]() 。
。
![]() 气体与
气体与![]() 相遇立即生成一种白色晶体:
相遇立即生成一种白色晶体:![]() 。
。
![]() 和
和![]() 分子的空间构型分别为 ______ 、 ______ 。
分子的空间构型分别为 ______ 、 ______ 。
![]() 晶体
晶体![]() 中,B原的杂化轨道类型为 ______ 。
中,B原的杂化轨道类型为 ______ 。
![]() 可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为
可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为![]() 的物质。该物质易溶于水,在水溶液中以
的物质。该物质易溶于水,在水溶液中以![]() 和
和![]() 两种正四面体构型的离子存在。
两种正四面体构型的离子存在。![]() 遇碱生成一种形似白磷的
遇碱生成一种形似白磷的![]() 分子。
分子。
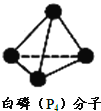
![]() 下列相关说法中,正确的是 ______
下列相关说法中,正确的是 ______ ![]() 填序号
填序号![]() 。
。
![]() 是
是![]() 的同分异构体
的同分异构体
![]()
![]() 分解生成
分解生成![]() ,形成了4mol
,形成了4mol![]() 键
键
![]() 白磷的沸点比
白磷的沸点比![]() 高,原因是
高,原因是![]() 键键能比
键键能比![]() 键大
键大
![]() 白磷的化学性质比
白磷的化学性质比![]() 活泼,说明P的非金属性比N强
活泼,说明P的非金属性比N强
![]() 画出
画出![]() 的结构
的结构![]() 标明其中的配位键
标明其中的配位键![]() : ______ 。
: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
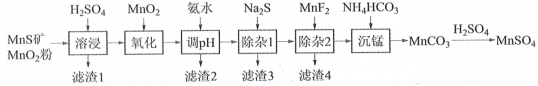
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀![]() pH范围如下:
pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8 3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)写出基态锰原子核外电子排布式___。
(2)“氧化”中添加适量的MnO2发生反应的离子方程式是___。
(3)“调pH”除铁和铝,溶液的pH范围应调节为___~6之间。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___。
(5)写出“沉锰”的离子方程式___。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补充完成下表:(请把序号①~⑦的答案填在相应的位置上)
元素 | 甲 | 乙 | 丙 |
元素符号 | ①______ | ②______ | O |
原子结构示意图 |
| ③______ | ④______ |
周期 | 三 | 三 | ⑤______ |
族 | ⑥______ | ⅦA | ⑦______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述符合的是( )

A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K与温度和压强的关系
2SO3(g)的平衡常数K与温度和压强的关系
C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH=4左右
D.图丁表示常温下向20mL0.001mol/L的醋酸溶液中滴加0.001mol/L的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,在生活、生产中的应用广泛。
(1)工业上利用二甲醚合成乙醇
反应①:CH3OCH3(g) + CO(g) ![]() CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g) + 2H2(g) ![]() CH3OH(g) + C2H5OH(g) △H2
CH3OH(g) + C2H5OH(g) △H2
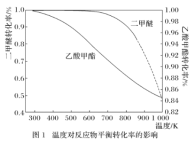
一定压强下,温度对二甲醚和乙酸甲酯平衡转化率影响如下图1所示,据图示判断,△H2________0(填“>”或“<”)。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如下图2所示。在300K~600K范围内,乙酸甲酯的百分含量逐渐增加,而乙醇的百分含量逐渐减小的原因是_____________。

(2)乙醇加入汽油(平均分子式为C8H18)中能改善油品质量,减少对环境的影响。
①乙醇汽油可提高燃油的燃烧效率,减少CO等不完全燃烧产物的生成。相同条件下,等物质的量的乙醇与汽油完全燃烧消耗氧气之比为_____________。
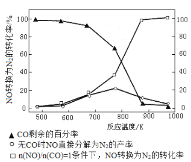
②NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以AgZSM5为催化剂,测得NO转化为N2的转化率随温度变化情况如上图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____________;在![]() =1的条件下,应控制的最佳温度在_____________左右,写出此条件下发生反应的化学方程式_____________。
=1的条件下,应控制的最佳温度在_____________左右,写出此条件下发生反应的化学方程式_____________。
(3)某乙醇燃料电池采用碱性介质,该电池工作时负极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com