
【题目】KI用于分析试剂、感光材料制药和食品添加剂等。
制备原理如下:反应① 3I2+6 KOH =a KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O

按照下列实验过程,请回答有关问题。
(1)启普发生器中发生的化学方程式为______________________,用该装置还可以制备___________(填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到______________________(填现象),停止滴人KOH溶液;然后______________________(填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液,并对KI混合液水浴加热,其目的是______________________。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和___________,其中加入碳酸钡的作用是______________________。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为___________g。
【答案】ZnS + H2SO4 ═ H2S↑+ Zn SO4 H2 (CO2) 棕黄色溶液变为无色 打开启普发生器活塞,通入气体 使溶液酸化并加热,有利于H2S溢出,从而除去H2S 硫 除去多余的硫酸 33.2g
【解析】
(1)启普发生器中发生的的反应用于制备H2S,属于固体与液体不加热的反应制气装置,用该装置还可以制备H2 (CO2) 等。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,发生① 3I2+6 KOH =a KIO3+5KI+3H2O,待观察到棕黄色溶液变为无色,停止滴人KOH溶液;然后通入H2S,完成反应② 3H2S+KIO3=3S↓+KI+3H2O,打开启普发生器活塞,通入气体,待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液使溶液酸化,并对KI混合液水浴加热,有利于H2S溢出,从而除去H2S。
(4)沉淀中有反应②生成的硫,过量的硫酸用碳酸钡除去。
(5)如果得到3.2g硫单质,则理论上制得的KI,根据方程式得关系式3S~6KI计算。
(1)启普发生器中发生的的反应用于制备H2S, 化学方程式为:ZnS + H2SO4 ═ H2S↑+ Zn SO4 ,属于固体与液体不加热的反应制气装置,用该装置还可以制备H2 (CO2) 等。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,发生① 3I2+6 KOH =a KIO3+5KI+3H2O,待观察到棕黄色溶液变为无色,停止滴人KOH溶液;然后通入H2S,完成反应② 3H2S+KIO3=3S↓+KI+3H2O,打开启普发生器活塞,通入气体,待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液使溶液酸化,并对KI混合液水浴加热,目的:使溶液酸化并加热,有利于H2S溢出,从而除去H2S。
(4)沉淀中有反应②生成的硫,过量的硫酸用碳酸钡除去。
把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和硫,其中加入碳酸钡的作用是除去多余的硫酸 。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为:
反应① 3I2+6 KOH =1KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O得关系式
S~2KI
32 2×166
3.2g m
m= 33.2g


科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示,下列叙述错误的是
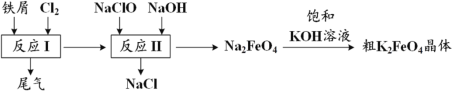
A.用 K2FeO4 作水处理剂时,既能杀菌消毒又能净化水
B.反应 I 中尾气可用 FeCl2 溶液吸收再利用
C.反应 II 中氧化剂与还原剂的物质的量之比为 2:3
D.该条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是 ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因 。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);G的基态原子电子排布式是
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是 ;该化合物中Y的杂化轨道类型是 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H =" -1160" kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 实验室制乙酸乙酯 | 比较碳酸与苯酚酸性强弱 | 加入CCl4分离碘水中的碘 | 蒸干FeCl3溶液制无水FeCl3 |
实验装置 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,下列叙述正确的是
A.18克液态水与18克冰中氢键数目均为NA
B.工业酸性废水中的Cr2O72-可转化为Cr3+除出,现用电解的方法模拟该过程,阴极为石墨,阳极为铁,理论上电路中每通过6mol电子,就有NA个Cr2O72-被还原
C.标准状况下,22.4LNO2含有的原子数小于3NA
D.1molLiAlH4在125℃完全分解成LiH、H2、Al,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
A.A中放热92.4kJ
B.B中放热46.2kJ
C.A中热量变化值大于B中2倍
D.A中热量变化值等于B中的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com