
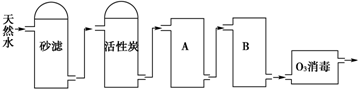
| ||
| ||
| ||
| ||
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、二氧化硫 |
| B、二氧化碳 |
| C、乙烯 |
| D、甲醛、苯、醚等挥发性有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、H+、SO42-、I- |
| B、K+、SO42-、Cl-、CO32- |
| C、Na+、Fe2+、H+、Cl- |
| D、Na+、K+、Al3+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在干旱地区植树造林时,可利用高吸水性树脂抗旱保水 |
| B、硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 |
| C、为补充人体所需的营养成分,人人都应食用添加营养强化剂的食品 |
| D、服用阿司匹林若出现水杨酸反应,应立即停药并静脉滴注NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B、电池放电后,电池中溶液的pH变大 |
| C、电池充电时,阴极反应为:Pb-2e-+SO2-4=PbSO4 |
| D、电池充电时,把铅蓄电池的正极与外电源负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其中丙是溶于水显酸性的气体,丁是强碱.
,其中丙是溶于水显酸性的气体,丁是强碱.查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素置X、Y、R、Q在元素周期表中的位置如图所示,其中Q元素是地壳中含量最高的元素.
短周期元素置X、Y、R、Q在元素周期表中的位置如图所示,其中Q元素是地壳中含量最高的元素.| 浓度/mol?L-1 时间/min |
NO | N2 | RO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | SO2水溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | BaSO3难溶于盐酸 |
| B | Al放入浓HNO3中 | 无明显现象 | Al表面被浓HNO3氧化形成致密的氧化膜 |
| C | Na2SiO3溶液中通入CO2气体 | 产生白色胶状沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com