
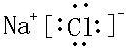 ,故答案为:
,故答案为: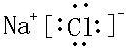 ;
;

科目:高中化学 来源: 题型:
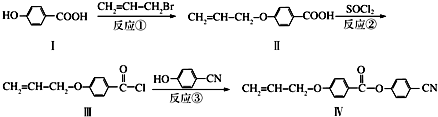
 也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y元素最高价氧化物对应水化物的化学式为HYO4 |
| B、原子半径由小到大的顺序为:W>X>Z |
| C、Z元素可以形成两种酸性氧化物 |
| D、Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
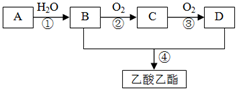 已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题:
已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3=2Na++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、NaHCO3=Na++HCO3- |
| D、KClO3=K++Cl-+3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:
为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:
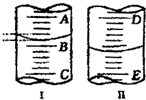 (1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是
(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com