
【题目】下列实验所选择的试剂、装置或仪器(夹持装置已略 去)能达到相应实验目的的是
A. 提取溴水中的溴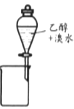
B. 验证石蜡油分解产物中含有烯烃
C. 验证H2O2 分解时二氧化锰的催化效果优于氯化铁
D. 量取20.00mL 0.1000mol/L HCl溶液
科目:高中化学 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)A的结构式为 ________________;C的结构简式为_________________;
(2)写出反应①的化学方程式_________________;
(3)反应③的反应类型为__________________;
(4)C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)______________;_______________。
(5)反应 ________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮肥是最重要的化肥,它能使农作物枝叶茂盛,叶片增大,促进叶绿素的形成,从而有利于光合作用,提高农作物产量和质量。
(1)氮气分子的电子式是_________,氨气分子的空间形状为:__________。
(2)农谚有“雷雨发庄稼”一说。用化学方程式表示在闪电作用下游离态氮转化为化合态氮的过程_____.
(3)合成氨工业是氮肥的最主要来源。写出工业合成氨的化学方程式 _________________.
(4)合成氨工业也是硝酸工业的基础,写出氨催化氧化的化学方程式_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题。
(1)基态氮原子的价电子排布图为________________。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ 键的数目为_____________。
②与CNO—互为等电子体的分子为_____________。(任写一种,填化学式)
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子,已知NF3和NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配合离子,其原因是_______。
(4)分子中的大 π键可用符合 πmn 表示,其中m表示形成大 π 键的原子数,n表示参与形成大 π 键的电子数(如苯分子中的大 π键可表示为π66)。则NO3-中的大 π键应表示为________________。
(5)多硼酸根的结构之一为链状(如图),其化学式为____________。

(6)氮化硼晶体有多种结构,其中立方氮化硼具有金刚石的结构(如图)。若晶胞边长为a nm,晶胞中N原子位于B原子所形成的正四面体的体心,则B—N键的键长为____nm,这种氮化硼晶体的密度为______g/cm3 。(用含有a和NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)简称“三盐”,不溶于水及有机溶剂。主要适用于不透明的聚氯乙烯硬质管、注射成型制品,也可用于人造革等软质制品。以铅泥 (主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。


已知:KSP(PbSO4)=1.82×10-8,KSP(PbCO3)=1.46×10-13请回答下列问题:
(1)写出步骤①“转化”的离子方程式__________________。
(2)根据右图溶解度曲线(g/100g水),由滤液I得到Na2SO4固体的操作为:将“滤液1”、_________、_________、用乙醇洗涤后干燥。
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是________________(任意写出一条)
(4)“滤液2”中可循环利用的溶质为_______(填化学式)。若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5 mol·L-1,则此时c(SO42-)=________mol·L-1。
(5)步骤⑥“合成”三盐的化学方程式为____________________。
(6)若消耗100.0t铅泥,最终得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有75%转化为三盐,则铅泥中铅元素的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素核电荷数均小于18。A元素原子核内无中子,B元素的原子L层电子数是K层电子数的3倍,C元素原子的M层电子数比K层电子数多1个,D2-离子比C3+离子多一个电子层。请回答:
(1)写出元素名称:A___、B___、C___、D___。
(2)画处C3+离子结构示意图_____。
(3)画出D2-离子的电子式_____。
(4)写出B、C形成的化合物的化学式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com