
【题目】元素X和元素Y位于第二周期,其中X的原子最外层中具有最多的未成对电子,Y的原子只有两种形状的电子云,且两种形状的电子云的电子数相等,则由x、y组成的微粒中,不可能存在的是
A. X2Y5 B. XY42- C. XY2- D. XY3-
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热
B. 在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热
C. 热化学方程式中,各物质前的化学计量数不表示分子个数
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。
已知:2NH3(g) ![]() N2 (g)+3H2(g) △H= 92.4 kJ·mol-1
N2 (g)+3H2(g) △H= 92.4 kJ·mol-1
2H2 (g)+O2 (g)=2H2O(g) △H= - 483.6 kJ·mol-1
NH3(l) ![]() NH3 (g) △H= 23.4 kJ·mol-1
NH3 (g) △H= 23.4 kJ·mol-1
(1) 4NH3(l)+3O2 (g)![]() 2N2(g)+6H2O(g) 的△H=______,该反应的平衡常数表达式为______。
2N2(g)+6H2O(g) 的△H=______,该反应的平衡常数表达式为______。
(2) 2NH3(g) ![]() N2(g)十3H2(g)能自发的条件是_________(填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线1。如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线_________(标注2)。
N2(g)十3H2(g)能自发的条件是_________(填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线1。如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线_________(标注2)。
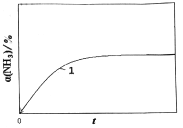
(3)有研究表明,在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,写出阴极的电极反应式______________________。
(4) 25℃时,将amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是

A. 图甲横坐标为原子序数,纵坐标表示元素的最高正价
B. 图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C. 图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D. 图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:

⑴ 该反应的化学方程式为:_________________________
⑵ 反应开始至2min,用Z表示的平均反应速率为:_____________
⑶ 下列叙述能说明上述反应达到化学平衡状态的是_____(填序号)
A.混合气体的总压强不随时间的变化而变化
B.混合气体的平均摩尔质量不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L丁烷中C—C键数目为0.4NA
B. 0.1mol葡萄糖分子中官能团数目为0.6NA
C. 28g N2和NO组成的混合物中分子数目可能为0.9NA
D. 1L pH =13的NaOH溶液中,Na+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”。香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁(C10H14N2)对人体危害最大,下列说法正确的是
A.尼古丁是由26个原子构成的物质
B.尼古丁中C、H、O 三种元素的质量比为10:14:2
C.尼古丁的相对分子质量是162g
D.尼古丁中氮元素的质量分数为17.3 %
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素⑧中质子数和中子数相等的同位素符号是:____________;
(2)④、⑤、⑥的离子半径由大到小的顺序为:________________;
(3)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为:______________;
(4)④、⑤两种元素的原子按1:1组成的常见化合物,其阴、阳离子个数比为:__________;
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知:液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
A.4种溶液pH的大小顺序:①>④>③>②
B.溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O)
C.向溶液①、②中分别加入25 mL 0.1mol/L盐酸后,溶液中c(NH4+):①>②
D.向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com