
【题目】图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是

A. 图甲横坐标为原子序数,纵坐标表示元素的最高正价
B. 图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C. 图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D. 图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
科目:高中化学 来源: 题型:
【题目】一定量的的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入
A.CH3COONa固体 B.Na2SO4固体 C.少量NH4HSO4固体 D. NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50mol·L-1盐酸与50 mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。回答下列问题:
(1)小烧杯中发生反应的离子方程式为: ________________________________;
(2)该实验中反应发生过程中,温度计显示温度上升,说明该反应是__________反应(填”放热”或”吸热”)
(3)从能量的角度看,断开化学键要________________;形成化学键要_________________________;
(4)将实验中的药品换为铝片和稀盐酸,温度计显示温度上升。发生反应的化学方程式为______________________,反应物的总能量__________生成物的总能量(填”大于”或”小于”)
(5)目前,全球仍主要处于化石能源时期,下列有关能源说法正确的是__________;
A.煤、石油、天然气属于矿石能源,是取之不尽用之不竭的,可以大量使用
B.沼气的主要成分是甲醇,是一种清洁能源
C.太阳能、氢能、核能等以后将成为提供能源的重要形式
D.可利用风能发电来缓解枯水季节的电能不足
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①泥浆中泥沙是溶质,水是溶剂
②医用酒精中,水是溶剂,酒精是溶质
③凡是分散质能通过半透膜的分散系即属于胶体
④通过丁达尔现象可以鉴别胶体和溶液
A.①②③④ B.②④ C.②③ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化合物![]() 的名称是2-乙基丁烷
的名称是2-乙基丁烷
B. 2-甲基丁烷和2,2-二甲基丙烷互为同系物
C. 常温下,乙烯和苯都能被酸性KMnO4氧化,使KMnO4溶液褪色
D. 等物质的量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A. NH4+、Cu2+、 Cl-、NO3- B. K+、Na+、CO32-、S2-
C. K+、Na+、 CH3COO-、SO42- D. Ba2+、Mg2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X和元素Y位于第二周期,其中X的原子最外层中具有最多的未成对电子,Y的原子只有两种形状的电子云,且两种形状的电子云的电子数相等,则由x、y组成的微粒中,不可能存在的是
A. X2Y5 B. XY42- C. XY2- D. XY3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )

A. 若在反应体系中加人催化剂,E1不变
B. 若在反应体系中加入催化剂,△H减小
C. 反应的活化能等于y kJmol-1
D. 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、M为元素周期表中前四周期的元素,其原子序数依次增大。X与W、Z与R是分别同族元素;X原子的第一电离能小于同周期前一族元素的原子;Z元素基态原子的核外有3个未成对电子;M元素的单质化学性质稳定,耐腐蚀,其单质及合金是一种优良的航天、航空材料,M的基态原子核外有2个未成对电子。请回答下列问题:
⑴NaZ3可应用于汽车安全气囊,当汽车发生碰撞时,气囊中的NaZ3迅速分解产生大量Z 的单质气体,从而使安全气囊瞬间充气弹出,减轻了乘员受到的伤害。基态Z原子价电子的电子排布图为_____________。与Z3-互为等电子体的分子的化学式为______________(写一个即可),Z3-的空间构型是__________。
⑵W元素可形成[WF6]3-、[WCl4]-配离子,而X只能形成[XF4]-配离子,由此可知决定配合物中配位数多少的因素之一是________________;
⑶已知Y的最高价含氧酸根离子与Na+、K+、NH4+形成的酸式盐溶解度都小于其正盐的溶解度,原因是HCO3-之间以________(填作用力)作用形成长链,减小了HCO3-与水分子之间的作用导致溶解度降低;
⑷R元素通常有白、红、黑三种颜色的单质,其中最稳定的同素异形体G在通常状态下是一种黑色有金属光泽的晶体,G在储能、电子和光伏发电等领域有着广泛的应用前景,是一种比石墨烯更优秀的新型材料。晶体G具有与石墨类似的层状结构,如图一所示。下列有关G的说法正确的是_______________;
A.G中R原子杂化方式为sp3杂化
B.G中层与层之间的作用力是配位健
C.与石墨类似,G的每一层中R原子都在同一平面上
D.R元素三种常见的单质中,G的熔沸点最高
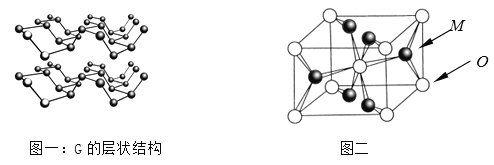
⑸M与O形成的离子晶体在自然界中存在三种形态,其中金红石型是三种形态中最稳定的一种,其晶胞如图二所示,则M、O配位数之比为________;影响离子晶体结构类型的因素有_____________、____________、键性因素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com