
【题目】化学反应A2(g)+B(g)=2AB(g)的能量交化如图所示。下列有关叙述不正确的是

A.AB(g)的键能为b kJ·mol-1
B.反应热△H=+(a-b)kJ·mol-1
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量
【答案】A
【解析】
由图可知,正反应的活化能即断裂1molA-A键和1molB-B键所需的能量为akJ,逆反应的活化能即断裂2molA-B键所需的能量为bkJ,反应热△H=断开化学键所需的能量-形成化学键放出的能量,由于反应物的总能量小于生成物的总能量,故反应吸热。
A.bkJ能量是断裂2molAB键所需的能量或形成2molAB所放出的能量,故A错误;
B.反应热△H=断开化学键所需的能量形成化学键放出的能量=+(ab)kJmol1,故B正确;
C.从图可以看出,此反应的反应物的总能量小于生成物的总能量,故C正确;
D.正反应的活化能为akJ,即断裂1molAA键和1molBB键所需的能量为akJ,故D正确。
答案选A。


科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。请回答下列问题。
(1)乙烯的电子式为____,结构简式为____。
(2)鉴别甲烷和乙烯可用的试剂是____(填字母)。
A 稀硫酸 B 溴的四氯化碳溶液
C 水 D 酸性高锰酸钾溶液
(3)已知2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
乙烯![]() A
A![]() B
B![]() 乙酸
乙酸
反应②的化学方程式为________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____,反应类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸丁酯的环境温度(反应温度)是115﹣125℃,其它有关数据如下表,则以下关于实验室制备乙酸丁酯的叙述错误的是( )
物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 98%浓硫酸 |
沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
溶解性 | 溶液水和有机物 | 溶液水和有机物 | 微溶于水,溶液有机物 | 与水混合 |
A.相对价廉的乙酸与1﹣丁醇的物质的量之比应大于1:1
B.不用水浴加热是因为乙酸丁酯的沸点高于100℃
C.从反应后混合物分离出粗品的方法:用Na2CO3溶液洗涤后分液
D.由粗品制精品需要进行的一步操作:加吸水剂蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.100 0 mol·L-1的NaOH溶液滴定20 mL0.1000 mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
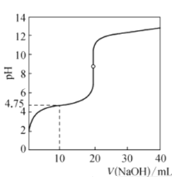
A.可用甲基橙溶液作该滴定过程的指示剂
B.当溶液中由水电离出的c水(OH-)=1×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴定到pH=4.75时,溶液中:c(Na+ )>c(A-)=c(HA)>c(OH- )
D.当滴入40 mL NaOH溶液时,溶液中:c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
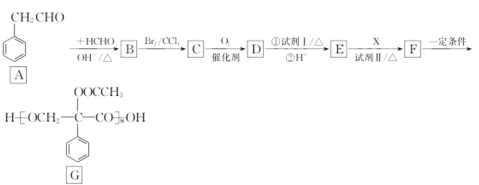
【题目】G是良好的生物医药缓释材料,其合成路线:
已知: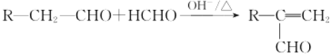
回答下列问题:
(1)A的化学名称为_______;B中官能团的名称为_________。
(2)由F生成G的反应类型为________。
(3)无机试剂I 、II分别为________、__________。
(4)物质X的结构简式是__________。
(5)写出D与试剂I的化学反应方程式:_____________________。
(6)Y是比D多1个碳原子的同系物,写出两种符合下列条件的Y的结构简式:________。
①能与饱和Na2CO3溶液反应放出气体;②苯环上有3个侧链,核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为6:2:1:1。
(7)参照以上合成路线,写出以甲醛、乙醛和乙二醇为主要原料合成功能高分子材料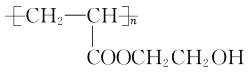 的路线:_______________________________(其他无机试剂任用)。
的路线:_______________________________(其他无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)新型洁净能源能够解决环境污染、能源短缺等问题,真正把“绿水青山就是金山银山”落实到我国的各个角落。氢气作为清洁高效、可持续“零碳”能源被广泛研究,而水煤气变换反应(WGSR)是一个重要的制氢手段。
(1)WGSR 的氧化还原机理和羧基机理如图所示。则热化学方程式CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH中,对ΔH表述错误的是________(填字母)。
CO2(g)+H2(g) ΔH中,对ΔH表述错误的是________(填字母)。
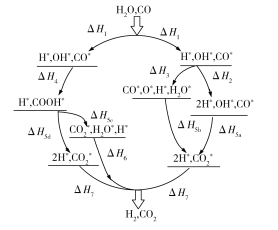
A.氧化还原机理途径:ΔH=ΔH1+ΔH2+ΔH5a+ΔH7
B.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5d+ΔH7
C.氧化还原机理途径:ΔH=ΔH1+ΔH3+ΔH5a+ΔH7
D.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5c+ΔH7
E.ΔH=ΔH1+![]() +ΔH7
+ΔH7
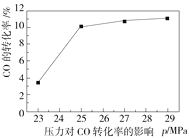
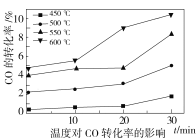
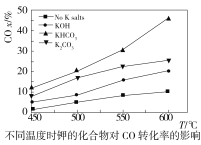
(2)水煤气变换反应在不同条件时CO的转化率不同,下图为压力、温度、不同温度时钾的化合物对CO的转化率的影响关系图,请认真观察图中信息,结合自己所学知识及生产实际,写出水煤气变换反应的条件:温度选择________℃;钾的化合物中_______催化效果最明显;压力选择______Mpa,选用此压力的原因为________。
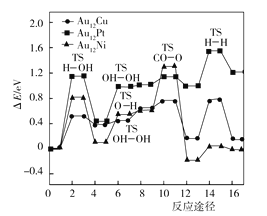
(3)如图是Au12Cu、Au12Pt、Au12Ni三种催化剂在合金团簇上WGSR最佳反应路径的基元反应能量图,反应能垒(活化能)最_______(填“高”或“低”)的步骤,为整个反应的速控步骤;三种催化剂催化反应的速控步骤__________(填“相同”或“不相同”);三种催化剂中,___________在合金团簇上的WGSR各基元反应能垒较小,对 WGSR 表现出较好的催化活性。
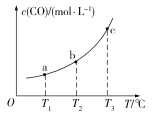
(4)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。若T1、T2、T3时的平衡常数分别为K1、K2、K3,则K1、K2、K3由小到大的关系为____________。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。若T1、T2、T3时的平衡常数分别为K1、K2、K3,则K1、K2、K3由小到大的关系为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
汽车的排气管上安装“催化转化器”,发生反应①:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
(1)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。
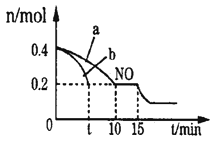
①图中a,b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__。(填“a”或“b”)
②T℃时,该反应的化学平衡常数K=__;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将__移动。(填“向左”、“向右”或“不”)
③15min时,若改变外界反应条件,导致n(NO)发生图中所示变化,则改变的条件可能是___(任答一条即可)。
④又已知:反应②N2(g)+O2(g)![]() 2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=__。
2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=__。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,如图为平衡时NO的体积分数与温度、压强的关系。

①温度:T1__T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率(脱硝率即NO的转化率)与温度、负载率(分子筛中催化剂的质量分数)的关系如图所示。
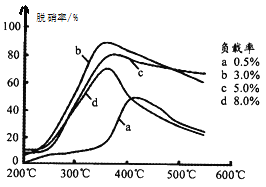
为达到最佳脱硝效果,应采取的条件是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的物质的量分数与溶液pH的关系如图乙所示,则下列说法中正确的是( )
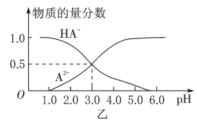
A.pH=4.0时,图中n(HA-)约为0.0091mol
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂
D.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是

A. b电极的反应式为CH3OCH3+3H2O-12e-==2CO2↑+12H+
B. 试剂A为饱和食盐水,试刑B为NaOH稀溶液
C. 阳极生成1 mol气体时,有1mol离子通过离子交换膜
D. 阴极生成1 mol气体时,理论上导线中流过2 mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com