
【题目】(1)分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2 200℃,熔融态不导电________;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电________;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中________;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________________________________________________________________________。
试推测ICl的沸点所处的最小范围________。

【答案】 原子晶体 分子晶体 分子晶体 离子晶体 相对分子质量越大,分子间的作用力越强 介于Br2的沸点和IBr的沸点之间
【解析】(1)A.原子晶体的熔点很高,熔融时不导电,已知碳化铝,黄色晶体,熔点2200℃,熔融态不导电,则碳化铝为原子晶体;B.分子晶体的熔点较低,易溶于有机溶剂,已知溴化铝,无色晶体,熔点98℃,熔融态不导电,则溴化铝是分子晶体;C.分子晶体的熔点较低,易溶于有机溶剂,已知五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、四氯化碳溶液等有机溶剂,说明五氟化钒是分子晶体;D.离子晶体熔融时或水溶液都能导电,已知溴化钾,无色晶体,熔融时或溶于水中都能导电,则溴化钾是离子晶体;(2)卤素单质和卤素互化物结构相似,均为分子晶体,相对分子质量越大,分子间的作用力越强,沸点越高;ICl的沸点所处的最小范围介于Br2的沸点和IBr的沸点之间。


科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示:

将 D 溶液滴入沸水中可得到以 F 为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体 F 微粒直径大小的范围:_____。
(2)A、B、H 的化学式:A_____、B_____、H_____。
(3)①写出 C 的酸性溶液与双氧水反应的离子方程式:_____。
②写出鉴定 D 中阳离子的实验方法和现象:_____。
③在 C 溶液中加入与 C 等物质的量的 Na2O2,恰好使 C 转化为 F,同时产生一种可使带火星木条复 燃的气体,写出该反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族)____________________。
(2)8个元素的最高价氧化物的水化物中,酸性最强的是___________________(填化学式)。
(3)①元素和⑥元素形成化合物的电子式是 ___________________________ 。
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:_______________________________________________ 。
(5)下列叙述正确的是______________(填字母)。
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。
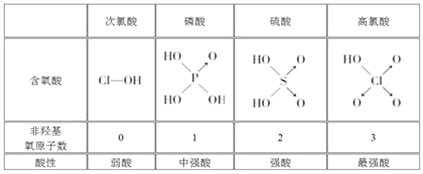
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:亚磷酸______________________,亚砷酸________________________。
(2)亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式分别是:
亚磷酸:______________________________________,
亚砷酸:_______________________________________。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,写出化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组取一定质量的镁铝合金材料投入200 mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如图所示。
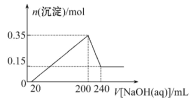
请回答下列问题:
(1)加入NaOH溶液0~20 mL时,发生反应的离子方程式为__________________________。
(2)加入NaOH溶液体积为220 mL时,沉淀的成分是________________________________。
(3)该合金材料中,镁、铝的物质的量之比为________________________。
(4)稀硫酸的物质的量浓度为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2=2M3++2R-
③2![]() +Z2=R2+2
+Z2=R2+2![]() 。由此判断下列说法正确的是
。由此判断下列说法正确的是
A.氧化性强弱顺序为XO42->Z2>R2>M3+
B.Z2在③中发生氧化反应
C.R元素在反应②中被氧化,在③中被还原
D.常温下反应不可进行2M2++Z2=2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出.
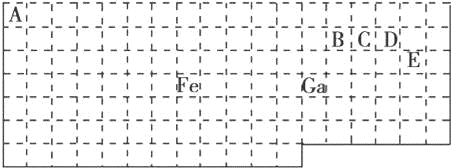
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的 区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 .
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO互为等电子体的分子和离子分别为 和 (填化学式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 .
(5)根据VSEPR模型预测ED4﹣的空间构型为 .B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为 (写2种).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A.Na2CO3是氧化物B.Na2CO3是盐
C.Na2CO3是钠盐D.Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列三种溶液:①45%的乙醇溶液、②汽油和氯化钾溶液、③氯化钠和单质碘的水溶液,分离上述各组混合液的正确方法依次是( )
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、分液、萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com