
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出.
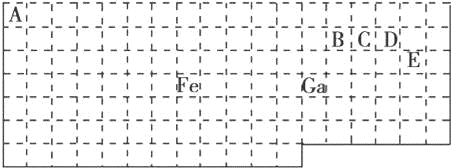
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的 区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 .
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO互为等电子体的分子和离子分别为 和 (填化学式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 .
(5)根据VSEPR模型预测ED4﹣的空间构型为 .B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为 (写2种).
【答案】(1)4s24p1;
(2)d;0;
(3)N2、CN﹣;
(4)CH4、CH3OH;
(5)正四面体;CO2CCl4.
【解析】试题分析:(1)Ga位于第四周期第IIIA族,最外层有3个电子;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的;根据化合物的化合价代数和为0分析;
(3)价电子数相同和原子数相同的微粒互称等电子体;
(4)先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式;
(5)价层电子对数=σ键电子对数+中心原子上的孤电子对数,根据价层电子对数判断微粒构型;根据元素周期表知,B、C、D、E分别是C、N、O、Cl是四种元素,若化合价的绝对值+原子最外层电子数=8,分子中每个原子最外层都达到8电子稳定结构,据此分析.
解:(1)Ga位于第四周期第IIIA族,最外层有3个电子,其最外层电子排布式为4s24p1;
故答案为:4s24p1;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的.Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,
这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,
根据能量最低原理先排4s电子后排3d电子,所以 最后排入的是3d电子,根据命名规则属d区,根据化合物化合价的代数和为0,Fe与CO易形成配合物Fe(CO)5化合价的代数和为0,CO的化合价的代数和为0,故答案为:d;0;
(3)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等.对于原子,原子序数=原子核外电子总数,所以,如果是分子,只要原子序数之和相等即可.CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2.
故答案为:N2、CN﹣;
(4)在CH4中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化.CH3OH中,价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.
故答案为:CH4、CH3OH;
(5)根据元素周期表知,E是Cl元素,D是O元素,ED4﹣是ClO4﹣离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,价层电子对数=4+![]() (7+1﹣4×2)=4,根据VSEPR理论预测ED4﹣离子的空间构型为正四面体型.
(7+1﹣4×2)=4,根据VSEPR理论预测ED4﹣离子的空间构型为正四面体型.
C、N、O、Cl是四种元素,两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2CCl4,故答案为:正四面体;CO2CCl4.


科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列结论错误的是 ( )

A. 完全电解2 mol H2O断裂的σ键键数为4NA
B. 标准状况下,11.2 L CO2中含有的π键键数为2NA
C. 60 g SiO2晶体中含有的Si—O键键数为4NA
D. 128 g金属铜中含有如图所示的晶胞数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解粗盐水(含Na+、Cl-和少量Mg2+、Br-)的装置如图所示(a、b均为石墨电极),下列说法正确的是

A. 电池工作时,负极反应式为:H2-2e-+2OH-=2H2O
B. a极的电极反应式为:2H++2e-=H2↑
C. 电解过程中电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.1 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2 200℃,熔融态不导电________;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电________;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中________;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________________________________________________________________________。
试推测ICl的沸点所处的最小范围________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型之间的关系如图所示,下列化学反应属于阴影部分的是
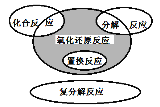
A. Cl2+2NaBr=== 2NaCl2+Br2
B. 4Fe(OH)2+O2+2H2O===4Fe(OH)3
C. 2NaHCO3![]() Na2CO3+CO2↑+ H2O
Na2CO3+CO2↑+ H2O
D. CH4 + 2O2 ![]() CO2 + 2H2O
CO2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.FeCl3 == Fe3+ + Cl3—
B.H2SO4 == 2H+ + SO42-
C.NaOH == Na+ + O2- + H+
D.Ca(NO3)2 == Ca2+ + 2(NO3)2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com