
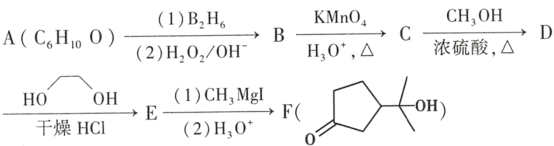
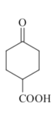
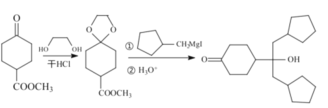
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如图:
已知:
① RCH=CH2 ![]() RCH2CH2OH
RCH2CH2OH
②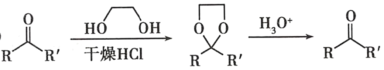
③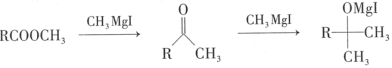
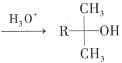
(1)A的结构简式为_____。
(2)B→C的反应类型为_____。
(3)C中官能团的名称为_____。
(4)C→D的化学方程式为_____。
(5)写出符合下列条件的D的同分异构体_____(填结构简式,不考虑立体异构)。
①含有五元环碳环结构;
②能与NaHCO3溶液反应放出CO2气体;
③能发生银镜反应。
(6)D→E的目的是_____。
(7)已知羟基能与格氏试剂发生反应。写出以 ![]() 、CH3OH 和格氏试剂为原料制备
、CH3OH 和格氏试剂为原料制备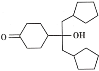 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
【答案】![]() 氧化反应 羰基和羧基
氧化反应 羰基和羧基 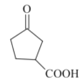 +CH3OH
+CH3OH![]()
 +H2O
+H2O 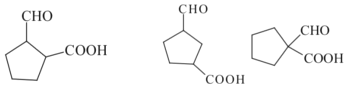 保护D中酮羰基,使其在E→F的转化过程中不参与反应
保护D中酮羰基,使其在E→F的转化过程中不参与反应 
![]()
![]()
【解析】
根据反应条件可知A发生信息①中的反应生成B,可知A中含有碳碳双键,B含有羟基。B中羟基被酸性高锰酸钾氧化后酸化生成C,C与甲醇发生酯化反应生成D,说明C中含有羧基,D发生信息②中的第一步反应生成E,E先发生信息③中反应,再发生信息②中第二步反应重新引入羰基生成F,由F的结构结合A的分子式逆推可得A为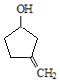 ,故B为
,故B为 、C为
、C为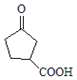 、D为
、D为 、E为
、E为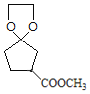 。
。
(1)根据分析可知A的结构简式为![]() ;
;
(2)B到C羟基转化为羧基,属于氧化反应;
(3)C为 ,其官能团为羰基、羧基;
,其官能团为羰基、羧基;
(4)C到D为酯化反应,化学方程式为 +CH3OH
+CH3OH![]()
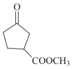 +H2O;
+H2O;
(5)D为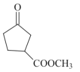 ,其同分异构体满足::①含有五元环碳环结构;②能与NaHCO3溶液反应放出CO2气体,说明含有羧基,③能发生银镜反应,说明含有醛基,则符合条件的同分异构体为:
,其同分异构体满足::①含有五元环碳环结构;②能与NaHCO3溶液反应放出CO2气体,说明含有羧基,③能发生银镜反应,说明含有醛基,则符合条件的同分异构体为: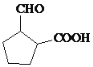 、
、 、
、![]() ;
;
(6)根据信息③可知酮羰基也可以需CH3MgI反应,而目标产物含有酮羰基,所以D→E的目的是保护D中酮羰基,使其在E→F的转化过程中不参与反应;
(7)参考生成F的转化,![]() 用酸性高锰酸钾溶液氧化生成
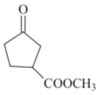
用酸性高锰酸钾溶液氧化生成![]() ,然后与乙醇反应生成
,然后与乙醇反应生成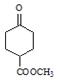 ,再与乙二醇生成
,再与乙二醇生成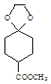 ,最后与
,最后与![]() 反应后酸性水解生成目标物,所以合成路线流程图为:
反应后酸性水解生成目标物,所以合成路线流程图为:
![]()

![]()
 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.用惰性电极电解 Na2SO4 溶液,当 2 mol 电子转移时,可加入 18 g 水恢复
B.用惰性电极电解 1 L 1 mol/L CuSO4 溶液,当加入 1 mol Cu(OH)2 恢复电解前浓度时, 电路中转移了 4 mol e-
C.用惰性电极电解 1 mol CuSO4 和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大
D.要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。
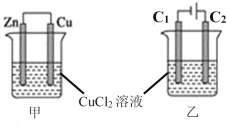
(1)甲装置中,Zn电极发生______反应(填“氧化”或“还原”),溶液中Cl-向_____极(填“Zn”或“Cu”)移动,Zn电极反应式为_______,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________。
(2)乙装置中,石墨电极C1是_______极,现象是______,C2极电极反应式为_______,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两个变化所发生的反应,属于同一类型的是
A.由苯制硝基苯、由乙醇制取乙酸乙酯
B.乙烯使溴的CCl4溶液褪色、甲苯使酸性高锰酸钾水溶液褪色
C.由HO-CH2-COOH制![]() 、由氯乙烯制聚氯乙烯
、由氯乙烯制聚氯乙烯
D.由氯乙烷制乙烯、由溴乙烷制乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验内容能达到实验目的的是
实验目的 | 实验内容 | |
A | 鉴别乙醇与乙醛 |
|
B | 比较乙酸、碳酸、苯酚的酸性 |
|
C | 说明烃基对羟基上氢原子活性的影响 | |
D | 说明苯环对取代基上氢原子活性的影响 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的式量与X最最高价氧化物的式量之比为17∶ 40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,乙与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X__________、Y_________、Z__________。
(2)X离子的结构简图为____________________。X与Y形成的离子化合物的化学式为___________________,Z和氢形成的化合物的化学式为________________。
(3)Y单质在空气中燃烧的化学方程式为 __________________________________,生成物与水反应的化学方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一。
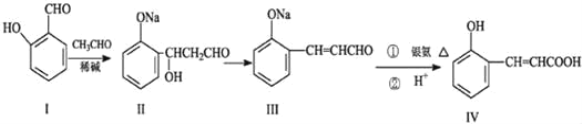
试回答:
(1)Ⅰ中官能团的名称______。
(2)Ⅱ→Ⅲ的反应类型______。
(3)①IV与乙醇在浓硫酸作用下发生酯化反应的方程式______。
②Ⅳ与过量NaOH溶液反应的化学方程式______。
(4)有机物X与IV互为同分异构体,且X有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出X的两种结构简式_______;
(5)下列说法正确的是_______。
A.Ⅰ的化学式为C7H8O2
B.Ⅰ遇氯化铁溶液呈紫色
C.Ⅱ能与NaHCO3溶液反应
D.1mol有机物IV最多能与4molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO![]() 等离子,过程如下:
等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
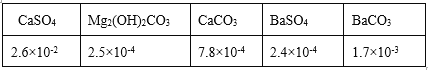
①检测Fe3+是否除尽的方法是______。
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因______。
③除去Mg2+的离子方程式是______。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____。
(3)第二次精制要除去微量的I-、IO![]() 、NH
、NH![]() 、Ca2+、Mg2+,流程示意如下:
、Ca2+、Mg2+,流程示意如下:
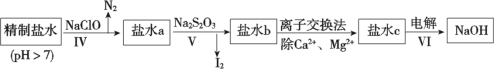
① 过程Ⅳ除去的离子是______。
② 盐水b中含有SO![]() 。Na2S2O3将IO
。Na2S2O3将IO![]() 还原为I2的离子方程式是________ 。
还原为I2的离子方程式是________ 。
③ 过程VI中,在电解槽的阳极发生反应的电极方程式是:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图装置研究气体X的性质,气体X的主要成分是Cl2,其中含有少量水蒸气。请回答下列问题:

(1)分别描述B、C装置中的现象____;结合化学方程式及物质性质说明B、C装置中现象不同的原因____。
(2)Cl2是有毒气体,为了防止多余Cl2污染空气,可以在D处用如图装置进行尾气处理,用化学方程式表示该原理____。气体应该由____(填“a”或“b”)管通入。若要吸收224mLCl2(标况下),至少需要1mol/L的上述溶液____mL。
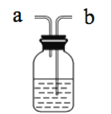
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com