
【题目】下列五种烃:①正丁烷②异丁烷③丙烷④辛烷⑤乙烷,按它们的沸点由高到低的顺序排列为
A. ④①②③⑤ B. ①④②③⑤ C. ⑤③②①④ D. ④①③⑤②
科目:高中化学 来源: 题型:
【题目】近几年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表达。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列四个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
A.Mg![]() Mg(NO3)2
Mg(NO3)2
B.Mg![]() MgCl2
MgCl2![]() Mg(OH)2
Mg(OH)2![]() Mg(NO3)2
Mg(NO3)2
C.Mg![]() MgO
MgO![]() Mg(NO3)2
Mg(NO3)2
D.Mg![]() MgSO4
MgSO4![]() Mg(NO3)2
Mg(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
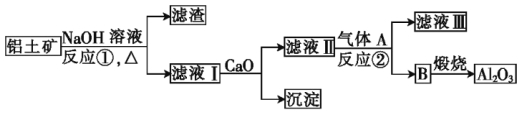
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
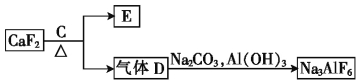
请回答下列问题:
(1)写出反应①的化学方程式: 。
(2)滤液Ⅰ中加入CaO生成的沉淀是 (填化学式),反应②的离子方程式为 。
(3)写出由气体D制备冰晶石的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,把溴置换出来,再用空气将嗅吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有①_________________(写出化学方程式);②3Br2+3CO![]() ===BrO
===BrO![]() +5Br-+3CO2↑;③BrO
+5Br-+3CO2↑;③BrO![]() +5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
+5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:______________________。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是________(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种药物合成的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
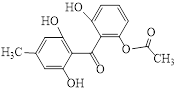
A. 化合物X的分子式为C16H16O6
B. 能发生加成反应、取代反应、消去反应
C. 1mol化合物X最多可与5molNaOH、7mol H2、4molBr2发生反应
D. 可与FeCl3溶液发生显色反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A. v(N2)=0.1mol·L-1·s-1 B. v(H2)=0.1mol·L-1·min-1
C. v(NH3)=0.15mol·L-1·min-1 D. v(H2)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物与人类生活密不可分,生活中的一些问题常涉及化学知识。
(1)有下列几种食品:

①花生油中所含人体所需的主要营养物质为___________(填“糖类”、“油脂”或“蛋白质”)。
②吃饭时,咀嚼米饭一会儿后感觉有甜味,是因为淀粉发生了_____________(填字母)反应。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法错误的是________。
A.用燃烧法鉴别毛织品和棉织品
B.用纯碱洗涤锅盖上的油渍
C.用闻气味的方法鉴别白酒和米醋
D.用淀粉溶液鉴别加碘食盐和不含碘的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

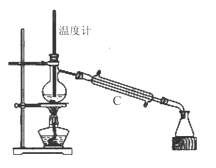
(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
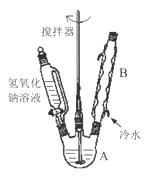
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com