
����Ŀ����1���������˻ᡰ��������������ܴ����Դ�ڱ����ȼ�գ�������һ��������ȼ�ϡ��Իش��������⣺
����ͼ��һ����������ȫȼ������CO2��1 mol H2O(l)�����е������仯ͼ������ͼ�е�������������������������_____��

��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��___________________________________��
��������(CH3OCH3)��һ������ȼ�ϣ�Ӧ��ǰ��������1 mol��������ȫȼ������CO2��Һ̬ˮ�ų�1 455 kJ��������1 mol����Ͷ����ѵĻ��������ȫȼ������CO2��Һ̬ˮ���ų�1835 kJ���������������У�����Ͷ����ѵ����ʵ���֮��Ϊ_______��
��2����ѧ�Ҹ�˹������������ܻ�ѧ������һ����ɻ�ּ�����ɣ�����ܹ��̵���ЧӦ����ͬ�ġ������ø�˹���ɿɲ�ijЩ�ر�Ӧ����ЧӦ��
��P4(s������)��5O2(g)===P4O10(s)����H1����2 983.2 kJ��mol��1
��P(s������)��5/4O2(g)===1/4P4O10(s)����H2����738.5 kJ��mol��1
�����ת��Ϊ�����Ȼ�ѧ����ʽΪ_________________________________________����ͬ��״���£������ϵ͵���________�������ȶ��ԱȺ���________(����������������)��
���𰸡��� C3H8 (g)��5O2(g)��3CO2 (g)��4H2O(l) ��H����2 215 kJ��mol��1 1��1 P (s������)===4P(s������) ��H����29.2 kJ��mol��1 ���� ��
��������
�ۺ�Ӧ�û�ѧ��Ӧ�е�������ϵͼ���Ȼ�ѧ����ʽ���Լ���˹���ɽ��м��������
(1)��ͼ�з�Ӧ���������������������������Ƿ��ȷ�Ӧ����H< 0������������
��1mol���飨C3H8����ȫȼ������4molH2O(l)������553.75kJ��mol��1��4mol��2215kJ����C3H8 (g)��5O2(g)��3CO2 (g)��4H2O(l) ��H����2 215 kJ��mol��1 ��
����1mol��������У���������ʵ���Ϊa mol��������ѵ����ʵ���Ϊ��1��a��mol����������2215 kJ��mol��1��a+1455kJ��mol��1��(1mol��a)��1835kJ,���a��0.5mol������Ͷ����ѵ����ʵ���֮��Ϊ1��1��
(2)�ݸ�˹�������Ȼ�ѧ����ʽ�ɼӼ����㣬���٣�����4�ð���ת��Ϊ�����Ȼ�ѧ����ʽP4(s������)��4P(s������) ��H����29.2 kJ��mol��1 ���ݴ˿ɼ�������ת��Ϊ�����Ƿ��ȹ��̣���ͬ״���£����������ϸߡ��ϲ��ȶ������������ϵ͡����ȶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl2��Һ��������Ӧ�����ӷ���ʽ��ȷ����(����)
A.2Fe2����Cl2��2Fe3����2Cl��
B.2FeCl2��Cl2��2FeCl3
C.Fe2����Cl2��Fe3����2Cl��
D.FeCl2��Cl2��FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��HCN(aq)��NaOH(aq)��Ӧ�Ħ�H=-12.1 kJ��mol-1��HCl(aq)��NaOH(aq)��Ӧ�Ħ�H=-55.6 kJ��mol-1����HCN��ˮ��Һ�е���Ħ�H����
A. -67.7 kJ��mol-1 B. -43.5 kJ��mol-1 C. +43.5 kJ��mol-1 D. +67.7 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���α������һ������Ѫ�����ŵĽ�Ѫѹҩ�һ�ֺϳ��α�����м���G�IJ����������£�

��֪���������Ľṹ��ʽΪ![]() ��
��
��ش��������⣺
��1��A��������______��B�����������ŵ�������______��
��2����Ӧ�ݵĻ�ѧ����ʽΪ______���÷�Ӧ�ķ�Ӧ������______��
��3��G�ķ���ʽΪ______��
��4��д����������������E��ͬ���칹��Ľṹ��ʽ��______��______��
������ֻ������ȡ����
��˴Ź�������ͼ��ֻ��4�����շ�
��.1mol������������NaHCO3��Һ��Ӧ����2molCO2
��5����������֪ʶ����������Ϣ��д����![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�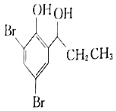 �ĺϳ�·������ͼ�����Լ���ѡ��______���ϳ�·������ͼʾ�����£�CH3CH2Br
�ĺϳ�·������ͼ�����Լ���ѡ��______���ϳ�·������ͼʾ�����£�CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�ڳ����¾�Ϊ���Է���Ӧ,�ڸ�������Ϊ���Է�����
A. 2Ag2O(s)=4Ag(s)+O2(g)
B. 2Fe2O3(s)+3C(s)=Fe(s)+3CO2(g)
C. N2O4(g)=2NO2(g)
D. 6C(s)+6H2O(l)=C6H12O6(s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ��ͨ���Ȼ�ѧѭ���ڽϵ��¶�����ˮ������ֽ��Ʊ������ķ�Ӧϵͳԭ����

ͨ�����㣬��֪ϵͳ��������ϵͳ���������������Ȼ�ѧ����ʽ�ֱ�Ϊ______________________________��__________________________________���Ƶõ���H2�����������ٵ���ϵͳ______������������
��2��H2S��CO2�ڸ����·�����Ӧ��H2S(g)+CO2(g) ![]() COS(g) +H2O(g)����610 Kʱ����0.10 mol CO2��0.40 mol H2S�����ݻ�Ϊ2.5 L�Ŀո�ƿ�У���Ӧƽ���ˮ�����ʵ�������Ϊ0.04��
COS(g) +H2O(g)����610 Kʱ����0.10 mol CO2��0.40 mol H2S�����ݻ�Ϊ2.5 L�Ŀո�ƿ�У���Ӧƽ���ˮ�����ʵ�������Ϊ0.04��
��H2S��ƽ��ת������=_______%����Ӧƽ�ⳣ��K��________�����÷�����ʾ��
����620 K�ظ��������飬ƽ���ˮ�����ʵ�������Ϊ0.05��H2S��ת������2______��1���÷�Ӧ����H_____0��������>����<������=����
����������Ӧ�����ٷֱ�����������壬��ʹH2Sת�����������________�������ţ�
A. H2S B. CO2 C.COS D.N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CaO2)������ˮ���ڳ������ȶ����ڳ�ʪ������ˮ�л����ֽ�ų�����������㷺Ӧ������ҵ��ũҵ������������档��ͼ���Դ���ʯ(��Ҫ������������)��Ϊԭ����ȡ��������(CaO2)�����̡�

��ش��������⣺
(1)������Ӧ�������в����е�____________��(�����)
A.�ܽ� B.���� C.���� D.��Һ E.�����ᾧ
(2)�ð�ˮ����pH��8��9��Ŀ����_________________________________��
(3)�������ҺC��c(CO32-)��10��3mol/L����Ca2��____(����������������)������ȫ��[��֪c(Ca2��)��10��5 mol/Lʱ������Ϊ������ȫ��Ksp(CaCO3)��4.96��10��9]
(4)������ҺC�У�����HNO3ʹ��Һ�������Եõ�������NH4NO3�����ữ����Һ��c(NH4+) _______c(NO3-)(�����ݡ������ܡ�����<������>����������)��
(5)�������ǣ��ڵ����£�����������Ũ��Һ��Ͷ����ˮ�Ȼ��ƽ��з�Ӧ��һ��ʱ����ټ�������������Һ����������ҺpH��9��11���ų��ִ���������д���÷�Ӧ�Ļ�ѧ����ʽ_________________________���ü�Ҫ�����ֽ������������Ƶ���pH��9��11��ԭ��____________��
(6)��֪����ʯ��CaCO3����������Ϊa��m g����ʯ�����Ƶ�n g CaO2������㣺CaCO3 ת��ΪCaO2�����У�Caԭ�ӵ�������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10L�ܱ������м���5molSO2��4molO2����10min��Ӧ��ƽ��ʱ��3molSO2�����˷�Ӧ���Լ��㣺
��1����SO2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ______��
��2��ƽ��ʱO2��ת����Ϊ______��
��3��ƽ��ʱO2�ڷ�Ӧ������е����ʵ�������______��
��4��ƽ�ⳣ��KֵΪ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com