
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
碱式碳酸镍的制备:
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],制备流程如图:
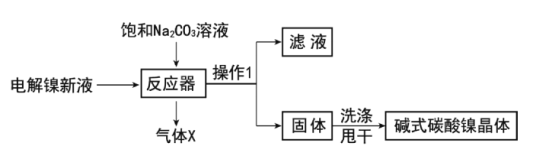
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3·2Ni(OH)2+3Na2SO4+2X,X的化学式为__。
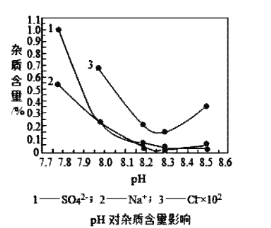
(2)物料在反应器中反应时需要控制反应温度和pH值。分析如图,反应器中最适合的pH值为__。
(3)检验碱式碳酸镍晶体洗涤干净的方法是__。
测定碱式碳酸镍晶体的组成:
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如图实验方案及装置:
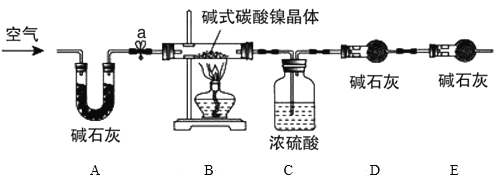
资料卡片:碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
实验步骤:
①检查装置气密性;
②准确称量3.77g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量并记录;
④__;
⑤打开弹簧夹a缓缓鼓入一段时间空气;
⑥分别准确称量装置C、D、E的质量并记录;
⑦根据数据进行计算(相关数据如下表)
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 251.08 | 190.44 | 190.00 |
实验分析及数据处理:
(4)E装置的作用__。
(5)补充④的实验操作___。
(6)通过计算得到碱式碳酸镍晶体的组成__(填化学式)。
镍的制备:
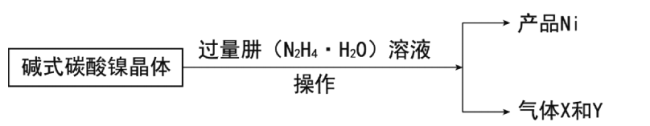
(7)写出制备Ni的化学方程式__。
【答案】CO2 8.3 取最后一次洗涤液少许,加入HCl酸化的BaCl2溶液,若无沉淀产生,则证明沉淀已经洗涤干净 吸收空气中的H2O和CO2 关闭弹簧夹a,点燃酒精灯,观察到C中无气泡时,停止加热 NiCO3·2Ni(OH)2·4H2O 2[NiCO3·2Ni(OH)2·4H2O]+3N2H4·H2O=6Ni+3N2↑+2CO2↑+21H2O
【解析】
(1)根据元素守恒分析判断 ;
(2)使各种杂质相对最少的pH即为最适合的pH ;
(3)反应后的滤液中含有硫酸钠,因此检验碱式碳酸镍晶体是否洗涤干净就是检验是否有硫酸根离子残留;
(4)根据实验目的和各个装置的作用分析;
(5)根据实验目的和前后操作步骤分析;
(6)先计算生成水蒸气和CO2的质量,再根据质量守恒确定化学式;
(7)氧化还原反应中电子有得,必有失,根据化合价变化确定生成物,进而配平方程式。
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3·2Ni(OH)2+3Na2SO4+2X,反应前Ni原子共3个、S原子共3个、O原子共23个、Na原子6个、C原子3个、H原子4个,反应后现有:Ni原子3个、S原子共3个、O原子共19个、Na原子6个、C原子1个、H原子4个,少O原子4个,C原子2个,而这些微粒包含在2个X分子中,所以X的化学式为CO2,故答案为:CO2 ;
(2)物料在反应器中反应时需要控制反应条件,根据图可知,在pH=8.3时,各种杂质相对最少,所以反应器中最适合的pH 8.3,故答案为:8.3 ;
(3)反应后的滤液中含有硫酸钠,因此检验碱式碳酸镍晶体是否洗涤干净就是检验是否有硫酸根离子残留,故答案为:取最后一次洗涤液少许,加入HCl酸化的BaCl2溶液,若无沉淀产生,则证明沉淀已经洗涤干净;
(4)C装置用来吸收碱式碳酸镍晶体受热分解产生的H2O,D装置用来吸收碱式碳酸镍晶体受热分解产生的CO2,E装置可以防止空气中的H2O和CO2进入D装置中,影响实验数据的测定,故答案为:吸收空气中的H2O和CO2;
(5)步骤③反应前左侧通空气是为了排尽装置中原有的CO2和水蒸气,避免装置内的CO2和水蒸气造成数据干扰,排空气后,应该开始进行反应,因此步骤④的操作为关闭弹簧夹a,点燃酒精灯,观察到C中无气泡时,说明固体分解完全,停止加热;步骤⑤再打开弹簧夹a缓缓鼓入一段时间空气,将装置中残留的CO2和水蒸气全部赶入C、D装置,被完全吸收,故答案为:关闭弹簧夹a,点燃酒精灯,观察到C中无气泡时,停止加热;
(6)水的质量为251.08g250g=1.08g,CO2的质量为190.44g190g=0.44g,由于发生的是分解反应,所以生成的NiO的质量为3.77g1.08g0.44g=2.25g,则分解反应中水、二氧化碳和NiO的系数比(也就是分子个数比)为即:![]() ,xNiCO3yNi(OH)2zH2O
,xNiCO3yNi(OH)2zH2O![]() .6H2O↑+CO2↑+3NiO,根据元素守恒可得可得x=1,y=2,z=4即xNiCO3yNi(OH)2zH2O中x:y:z的值1:2:4,故答案为:NiCO3·2Ni(OH)2·4H2O;
.6H2O↑+CO2↑+3NiO,根据元素守恒可得可得x=1,y=2,z=4即xNiCO3yNi(OH)2zH2O中x:y:z的值1:2:4,故答案为:NiCO3·2Ni(OH)2·4H2O;
(7)NiCO3·2Ni(OH)2·4H2O与N2H4·H2O反应生成Ni,Ni元素得电子,被还原,同时还生成气体X和Y,由第(1)问知X为CO2,氧化还原反应有得电子,必有失电子的物质,由此判断另一种气体为N2,根据得失电子守恒、元素守恒配平制备Ni的化学方程式,故答案为:2[NiCO3·2Ni(OH)2·4H2O]+3N2H4·H2O=6Ni+3N2↑+2CO2↑+21H2O。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】Y是一种天然除草剂,其结构如图所示,下列说法正确的是( )

A.Y可以和Na2CO3溶液发生反应
B.Y分子中所有碳原子一定在同一平面内
C.1 mol Y 最多能与6 mol NaOH反应
D.Y与足量的H2加成反应的产物含7个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:
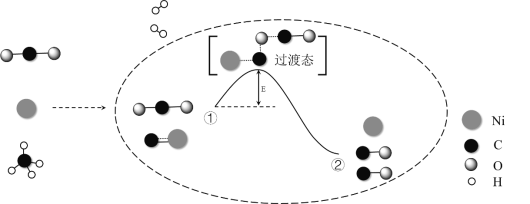
下列说法不正确的是
A. 合成气的主要成分为CO和H2
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. ①→②吸收能量
D. Ni在该反应中做催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是( )
)的说法正确的是( )
A.a、b、c的分子式均为C8H8
B.a、b、c均能与溴水发生反应
C.a、b、c中a,c能使高锰酸钾溶液褪色
D.a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是
A. 6个碳原子有可能都在一条直线上 B. 6个碳原子不可能都在一条直线上
C. 6个碳原子有可能都在同一平面上 D. 6个碳原子不可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
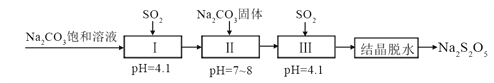
①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
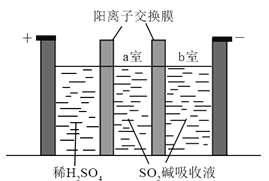
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。
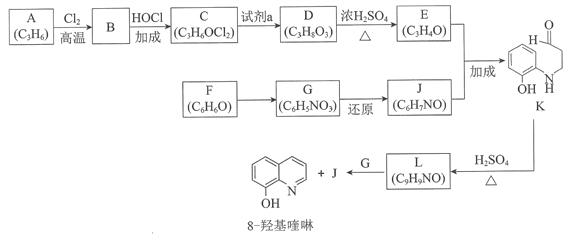
已知:i. 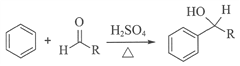
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________
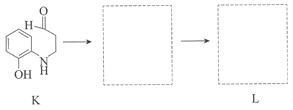
(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com