
【题目】分别向等体积的不含O2、含有O2的0.1mol·L1BaCl2溶液中通入SO2,探究体系中物质间的相互作用,实验记录如下。(已知:pH越小,溶液酸性越强)
pH变化 |
|
溶液中是否产生沉淀 | 不含O2的BaCl2溶液中没有白色沉淀,含有O2的BaCl2溶液中产生白色沉淀。 |
下列说法不正确的是
A.a所示溶液的pH降低的原因:SO2与H2O反应生成H2SO3,溶液的c(H+)增大
B.b所示溶液中发生反应:2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+
C.b比a所示溶液的pH小的原因:Ba2++SO2+H2O=BaSO3↓+2H+
D.SO2通入不含O2的BaCl2溶液后,再通入NH3,产生BaSO3沉淀
科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有平衡体系:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,为了增加甲醇的产量,应采取的压强措施是
CH3OH(g) ΔH<0,为了增加甲醇的产量,应采取的压强措施是
A.高温、高压B.适宜温度、高压、催化剂
C.低温、低压D.高温、高压、催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池:
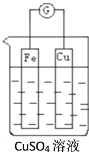
Cu电极是___(填“正”或“负”)极,其电极反应式为___;电子由___极流出。
(2)利用(1)图中的电极和电解液,在增加电源后可以实现电能转化为化学能,Fe接入电源负极,Cu接入电源正极,电解过程电极质量增加的是___(填“Fe”或“Cu”),Fe的腐蚀速度比正常在空气中的腐蚀速度___(填“快”或“慢”),溶液中c(Cu2+)___(填“增大”、“减小”或“不变”)。
(3)利用氢气与氧气的燃烧反应2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1,作为燃料电池的反应原理,可以提高能量的利用率,填充H2的电极是____(填“正”或“负”)极;当有11.2L(折算成标准状况下的体积)H2反应,会放出___kJ热量;如果2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,则a___571.6(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B和C为短周期元素,原子序数依次减小,A的最低负化合价为![]() ,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等.回答下列问题:
,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等.回答下列问题:
![]() 、B和C分别为 ______ 、 ______ 、 ______
、B和C分别为 ______ 、 ______ 、 ______ ![]() 用元素名称表示
用元素名称表示![]() 。
。
![]() 由以上元素组成的化合物中,属于离子化合物的是 ______ ,属于共价化合物的是 ______
由以上元素组成的化合物中,属于离子化合物的是 ______ ,属于共价化合物的是 ______ ![]() 各写一种即可
各写一种即可![]() 。
。
![]() 的常见气态氢化物的电子式为 ______ ,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有 ______
的常见气态氢化物的电子式为 ______ ,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有 ______ ![]() 填化学键的种类
填化学键的种类![]() ,该离子氯化物的水溶液呈 ______ 性,用离子方程式表示为 ______ 。
,该离子氯化物的水溶液呈 ______ 性,用离子方程式表示为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能在一定条件下可转化为电能。
(1)如图所示装置中锌片是______(填“正极”或“负极”),其电极反应式是______。溶液中H+移向______(填“锌”或“石墨”)电极。
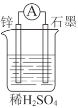
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①2H2+O2=2H2O②HCl+NaOH=NaCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代社会生活离不开能量。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用______(填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面______(填序号)反应释放的热量加热食物。
A.生石灰和水B.Ba(OH)2·8H2O和NH4Cl
(3)天然气的主要成分是甲烷,它是一种清洁能源。甲烷燃烧是______(填“放热”或“吸热”)反应,其能量变化可用如图中的______(填序号)表示。
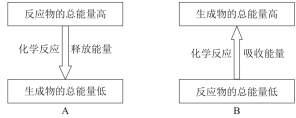
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmolˉ1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合, 其热化学方程式为:H++OH-=H2O; △H =-57.3 kJmolˉ1
C.已知 H2 燃烧热为 142.9kJmolˉ1 ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1);△H =-285.8 kJmolˉ1
D.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) ;△H=-38.6kJ· mol-1
2NH3(g) ;△H=-38.6kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素![]() 的碱性溶液制氢气的装置示意图
的碱性溶液制氢气的装置示意图![]() 电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极
电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极![]() 。
。
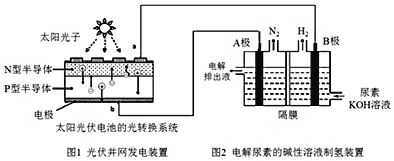
(1)图1中N型半导体为______![]() 填“正极”或“负极”
填“正极”或“负极”![]()
(2)该系统工作时,A极的电极反应式为______
(3)若A极产生![]()
![]() ,则此时B极产生______L
,则此时B极产生______L![]() 标况下
标况下![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com