
【题目】化学能在一定条件下可转化为电能。
(1)如图所示装置中锌片是______(填“正极”或“负极”),其电极反应式是______。溶液中H+移向______(填“锌”或“石墨”)电极。
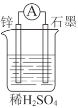
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①2H2+O2=2H2O②HCl+NaOH=NaCl+H2O
科目:高中化学 来源: 题型:
【题目】将质量相等的铁片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图的装置:
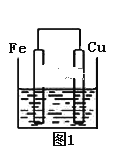
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,
(2)铜片周围溶液会出现___________的现象。
(3)若2 min后测得铁片和铜片之间的质量差为3.6 g,计算:导线中流过的电子的物质的量为__________mol;
(4)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,科学家用乙烷C2H6作为燃料,氧气作助燃剂,铂作电极,稀硫酸溶液为电解质溶液。制作了一个燃料电池,提高了乙烷的利用效率乙烷燃料电池的正极电极反应式:_____________。负极电极反应式:_________电池工作一段时间后电解质溶液的PH_____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ___ |
(2) | 乙炔 | ___ | ___ |
(3)D装置中氢氧化钠溶液的作用___。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯![]() 甲
甲![]() 乙
乙![]() PVC
PVC
(4)甲的结构简式是___;
(5)反应③的化学方程式是__。
(6)下列说法正确的是___。
A.乙烯可以作为植物生长调节剂
B.PVC不能使酸性高锰酸钾溶液褪色
C.PVC中的官能团是碳碳双键和氯原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,
时,![]() 橘红色
橘红色![]() 在水溶液中沉淀溶解平衡曲线如图所示。又知AgCl的
在水溶液中沉淀溶解平衡曲线如图所示。又知AgCl的![]() 下列说法正确的是
下列说法正确的是
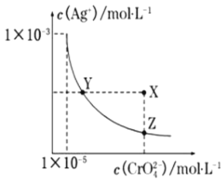
A.将![]() 溶液滴加到KCl溶液中,反应的活化能几乎为零
溶液滴加到KCl溶液中,反应的活化能几乎为零
B.![]() 时,
时,![]() 的
的![]()
C.饱和![]() 溶液中,加入水能使溶液由X点变为Y点
溶液中,加入水能使溶液由X点变为Y点
D.![]() 时,AgCl比
时,AgCl比![]() 的溶解度大
的溶解度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向等体积的不含O2、含有O2的0.1mol·L1BaCl2溶液中通入SO2,探究体系中物质间的相互作用,实验记录如下。(已知:pH越小,溶液酸性越强)
pH变化 |
|
溶液中是否产生沉淀 | 不含O2的BaCl2溶液中没有白色沉淀,含有O2的BaCl2溶液中产生白色沉淀。 |
下列说法不正确的是
A.a所示溶液的pH降低的原因:SO2与H2O反应生成H2SO3,溶液的c(H+)增大
B.b所示溶液中发生反应:2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+
C.b比a所示溶液的pH小的原因:Ba2++SO2+H2O=BaSO3↓+2H+
D.SO2通入不含O2的BaCl2溶液后,再通入NH3,产生BaSO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z属于原子序数依次增大的六种短周期主族元素,已知U与X同主族,它们之间的关系如下:
Ⅰ![]() 元素原子的核电荷数:
元素原子的核电荷数:![]()
Ⅱ![]() 可分别和V、W、Y、Z形成具有相同电子数的共价化合物甲、乙、丙、丁
可分别和V、W、Y、Z形成具有相同电子数的共价化合物甲、乙、丙、丁
Ⅲ![]() 、V元素原子的最外层电子数之和与之差分别等于X元素原子的核外电子数与最外层电子数。
、V元素原子的最外层电子数之和与之差分别等于X元素原子的核外电子数与最外层电子数。
请回答下列问题:
![]() 写出下列元素的名称:X______;乙的结构式______。
写出下列元素的名称:X______;乙的结构式______。
![]() 由U、W、X、Y四种元素形成的一种式量为120的物质,溶于水时破坏的是______
由U、W、X、Y四种元素形成的一种式量为120的物质,溶于水时破坏的是______
A.共价键![]() 离子键
离子键![]() 分子间作用力
分子间作用力![]() 氢键
氢键
![]() 、V、W和Y组成一种物质,其原子个数之比为5:1:3:1;该化合物具有还原性。
、V、W和Y组成一种物质,其原子个数之比为5:1:3:1;该化合物具有还原性。
①写出该化合物与过量稀NaOH溶液反应的离子方程式:______;
②请设计实验证明该化合物具有还原性:______。
![]() 常用作多彩水泥的添加剂,可用钴的某种氧化物与HZ溶液反应制备
常用作多彩水泥的添加剂,可用钴的某种氧化物与HZ溶液反应制备![]() 其中Co的化合价为
其中Co的化合价为![]() 、
、![]() 。现取适量这种钴的氧化物,可与480mL
。现取适量这种钴的氧化物,可与480mL![]() 溶液恰好完全反应,得到
溶液恰好完全反应,得到![]() 溶液和
溶液和![]() 黄绿色气体
黄绿色气体![]() 标准状况
标准状况![]() 。则该反应的化学反应方程式为______。
。则该反应的化学反应方程式为______。
![]() 由Z元素组成的单质戊,化工厂常用浓氨水检验运输戊的管道是否泄漏,如泄漏则会在管道周围产生大量白烟,反应的化学方程式为_______。
由Z元素组成的单质戊,化工厂常用浓氨水检验运输戊的管道是否泄漏,如泄漏则会在管道周围产生大量白烟,反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、Q是原子序数依次增大的前四周期元素。W是宇宙中最丰富的元素;X、Z 元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含Q2+的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
(1)第一电离能 Y ________________ Z,电负性 Y ________________ Z(填“大于”、“小于”或“等于”)。
(2)写出与XZ分子互为等电子体的一种离子的化学式________________。
(3)若向含有Q2+ 的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有_____________色晶体析出,该晶体中,中心离子的电子排布式为________________,配体为________________。
(4)已知 W 、 Y 形成的一组二元化合物化学式:![]() 、
、![]() 、
、![]() 、
、![]() 其中,
其中,![]() 分子中 Y 原子的杂化类型为________________;这组化合物的通式为________________。W、Y 形成的化合物的种类比 W、X 形成的化合物的种类________________ 填“多”或“少”。
分子中 Y 原子的杂化类型为________________;这组化合物的通式为________________。W、Y 形成的化合物的种类比 W、X 形成的化合物的种类________________ 填“多”或“少”。
(5)Q单质的晶体属于面心立方最密堆积。已知 Q 单质的密度是 ![]() ,NA表示阿伏加德罗常数的值,Q 的相对原子质量为 M,则 Q 晶体中最邻近的原子核间距为________________ cm 用含 M、d、NA 的代数式表示 。Q原子在晶胞中的空间利用率为________________(用含N的代数式表示)。
,NA表示阿伏加德罗常数的值,Q 的相对原子质量为 M,则 Q 晶体中最邻近的原子核间距为________________ cm 用含 M、d、NA 的代数式表示 。Q原子在晶胞中的空间利用率为________________(用含N的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应 2A(s)+3B(g) ![]() C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
A.加入催化剂,B的转化率提高
B.升高温度,平衡向逆反应方向移动,v(正)减小
C.压强增大一倍,平衡不移动,v(正)、v(逆)不变
D.恒温恒容充入 Ne,容器内压强增大,V(正)、V(逆)均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 NaOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错 误的是( )
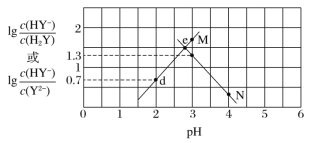
A.曲线 M 表示 pH 与 lgc(HY-)/c(H2Y)的变化关系
B.Ka2(H2Y)=10-4.3
C.d 点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(Na+)
D.交点 e 的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com