
����Ŀ����������ȵ���Ƭ��ͭƬ�õ�����������500 mL����ͭ��Һ�й�����ͼ��װ�ã�
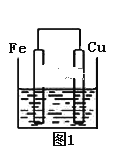
�����¾����跴Ӧ��������Һ������䣩��
��1����Ƭ�ϵĵ缫��ӦʽΪ______________��
��2��ͭƬ��Χ��Һ�����___________������
��3����2 min������Ƭ��ͭƬ֮���������Ϊ3.6 g�����㣺�����������ĵ��ӵ����ʵ���Ϊ__________mol��
��4������Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ��ȼ�ϵ����һ�ָ�Ч�������ѺõĹ���װ�ã���ѧ��������C2H6��Ϊȼ�ϣ���������ȼ���������缫��ϡ������ҺΪ�������Һ��������һ��ȼ�ϵ�أ���������������Ч������ȼ�ϵ�ص������缫��Ӧʽ��_____________�������缫��Ӧʽ��_________��ع���һ��ʱ���������Һ��PH_____________����������������С����������������
���𰸡�Fe-2e-=Fe2+ ��Һ��ɫ��dz 0.06 7O2+28e-+28H+=14H2O 2C2H6-28e-+8H2O=4CO2+28H+ ����
��������
��1������ͭ���ã�Ϊԭ��صĸ�������ʧ���ӷ���������Ӧ��
��2��ͭΪ��������Һ�е�ͭ�����������õ��ӷ�����ԭ��Ӧ��
��3�����������ܽ⣬����������ͭ����Ƭ��ͭƬ��������Ϊ�ܽ���������ͭ������֮�ͣ��ܽ��������ʵ���������ͭ�����ʵ�����ȣ����ݽ�����ת�Ƶ���֮��Ĺ�ϵʽ���㣻
��3������ȼ�ϵ��������������������ԭ��Ӧ�������ڸ�������������Ӧ���ܷ�Ӧ����������������Ӧ���ɶ�����̼��ˮ������ȼ�ϵ�ص��ܷ�Ӧ����ʽ�ж���ҺPH�ı仯��
(1) ����ͭ���ã�Ϊԭ��صĸ���������������Ӧ���缫����ʽΪFe2e=Fe2+��
�ʴ�Ϊ��Fe2e=Fe2+��
��2��ͭΪ������������ԭ��Ӧ���缫����ʽΪCu2++2e=Cu����ͭƬ��Χ��Һ�������Һ��ɫ��dz������
�ʴ�Ϊ����Һ��ɫ��dz��
(3)��ת��xmol����,������0.5xmolFe,����0.5xmolCu,����0.5x��(64+56)=3.6��x=0.06��
�ʴ�Ϊ��0.06��
(4)����ȼ�ϵ�ص����������õ��ӷ�����ԭ��Ӧ�������ǵ�ʧ����������ȣ����������������ʱ�����缫��ӦΪ��7O2+28e-+28H+=14H2O ���������鷢��������Ӧ���缫��ӦʽΪ�� 2C2H6-28e-+8H2O=4CO2+28H+ ���ܷ�Ӧ����������������Ӧ����ˮ,�䷴Ӧ���ܷ���ʽΪ��2C2H6+7O2=6H2O+4CO2����������ˮ��Һ�����������Ũ�ȼ�С��PH����
�ʴ�Ϊ��7O2+28e-+28H+=14H2O ��. 2C2H6-28e-+8H2O=4CO2+28H+ �� ����


 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Һ���й���������ȷ����
��� | �� | �� | �� | �� |
pH | 11 | 11 | 3 | 3 |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
A. �ۢ��зֱ���������Ĵ����ƾ��������Һ��pH������
B. �ڢ�����Һ�������ϣ�������Һ��c(H��)��c(OH��)
C. �ֱ��ˮϡ��10����������Һ��pH�٣��ڣ��ܣ���
D. V1L����V2L����Һ��Ϻ�����Ϻ���ҺpH��7����V1��V2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������һ����Ҫ�Ĺ�ҵԭ�ϣ��л���ѧ��ͨ��������Ӧԭ�������Խ��б���������ĺϳɡ��й����ʵ��������ʡ�ʵ��װ��������ʾ��
������ | �״� | ��������� | |
�۵�/�� | 122.4 | ��97 | ��12.3 |
�е�/�� | 249 | 64.3 | 199.6 |
�ܶ�/g��cm��3 | 1.2659 | 0.792 | 1.0888 |
ˮ���� | �� | ���� | ���� |
ʵ��һ����ȡ���������
�ڴ��Թ��м���15g�������һ�����ļ״�������������һ����Ũ���ᣬ��ͼA����������ʵ�顣

(1)��������״���Ӧ�Ļ�ѧ����ʽΪ______________________________________��
(2)��ѧʵ��������ȡ��������ʱΪ��������IJ��ʿ��Բ�ȡ�Ĵ�ʩ��___________________________
ʵ������ᴿ���������
��ʵ��Ҫ������ͼBװ�ð�ͼA���Ʊ��ı��������ˮϴ�ᴿ��������ͼCװ�ý��������ᴿ
(3)��ͼBװ�ý���ˮϴ�ᴿʱ��Bװ���й���Na2CO3������__________________��
(4)��ͼCװ�ý��������ᴿʱ�����¶ȼ���ʾ____________ʱ��������ƿ�ռ������������
(5)������ȡ15g���������������ñ���������IJ���Ϊ______________(С�������1λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ֱ����ݻ��̶����ܱ������г���A������B��������Ӧ���£�2A(g)+B(s)![]() 2D(g)��H��0,�������������£�������֪����˵������ȷ����
2D(g)��H��0,�������������£�������֪����˵������ȷ����
ʵ���� | ʵ���� | ʵ���� | |
��Ӧ�¶�/�� | 800 | 800 | 850 |
c(A)��ʼ/mol��L��1 | 1 | 2 | 1 |
c(A)ƽ��/mol��L��1 | .0.5 | 1 | 0.85 |
�ų�������/kJ | a | b | c |
A.ʵ��III�Ļ�ѧƽ�ⳣ��K��1
B.ʵ��ų���������ϵΪb��2a
C.ʵ��III��30min�ﵽƽ��ʱ������v(A)Ϊ0.005mol L-1��min-1
D.�������������ܶȲ���ʱ����仯ʱ������Ӧ�ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84������Һ(��ҵ����Cl2��NaOH��Ӧ�Ƶã�������������Ư�ף�����ʵ������ķ�������ȷ����
ʵ����� |
|
|
|
ʵ������ | ��Ϻ���Һ��pH=9.9,��ʱ����δ��ɫ��һ��ʱ�����ɫ��ȥ�� | ��Ϻ���ҺpH=5.0����ɫѸ����ȥ������������� | ��Ϻ���ҺpH=3.2����ɫѸ����ȥ���������������壬ʹʪ��ĵ��۵⻯����ֽ������ |
A.�Ա�ʵ����������������ɫѸ����ȥ��ԭ���Ƿ����˷�ӦClO+H+�THClO
B.ʵ�����в�����������Cl2����HClO�ֽ�õ���2HClO�TCl2��+H2O
C.�Ա�ʵ������������Һ��pH���ܻ�Ӱ��ClO�������Ի�Cl�Ļ�ԭ��
D.������������84������Һ��Ư��Ч��������Ҫ���غ��ʵ�pH���ܰ�ȫʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͬϵ������� ��
A. ![]() ��
��![]() B. CH3CH2Cl��CH2ClCH2CH2Cl
B. CH3CH2Cl��CH2ClCH2CH2Cl
C. C2H5OH��CH3OH D. CH3CH2CH3��CH2=CHCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ䷴Ӧ�IJ�����һ��������ͬ���칹�����
A. CH3-CH=CH2��HBr B. ![]() ��NaOH�Ҵ���Һ����
��NaOH�Ҵ���Һ����
C. CH3CH3��Cl2 D.  ��NaHCO3��Һ
��NaHCO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������ܱ������н��еķ�Ӧ��X(g) + Y(g)![]() 2Z(g)������˵���ܳ��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���� ( )
2Z(g)������˵���ܳ��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���� ( )
A.X��Y��Z��Ũ�����B.�����淴Ӧ���ʾ�������
C.X��Y��Z�������й���D.X��Y��Z��Ũ�Ⱦ����ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����һ�������¿�ת��Ϊ���ܡ�
��1����ͼ��ʾװ����пƬ��______����������������������������缫��Ӧʽ��______����Һ��H+����______������п������ʯī�����缫��
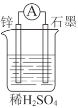
��2�����з�Ӧͨ��ԭ���װ�ã���ʵ�ֻ�ѧ��ֱ��ת��Ϊ���ܵ���______������ţ���
��2H2��O2=2H2O��HCl��NaOH=NaCl��H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com