
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知:
| | 颜色、状态 | 沸点(℃) | 密度(g·cm-3) |
| *苯甲酸 | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
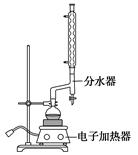
科目:高中化学 来源: 题型:实验题
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下: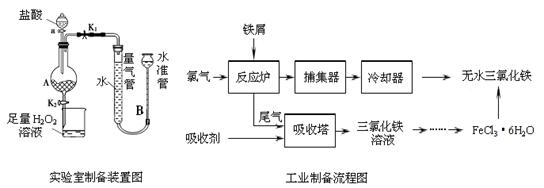
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2) 废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。在纺织工业中用于棉织品漂白后的脱氯剂、染毛织物的硫染剂、靛蓝染料的防白剂、纸浆脱氯剂、医药工业中用作洗涤剂、消毒剂和褪色剂等,它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2 气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~450C左右干燥50~60min,称量。请回答以下问题:
(1)仪器b的名称是 ;
(2)步骤②中若控制PH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体试剂的结构式是 。
(5)下列有关抽滤的说法中,正确的是 。
A.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量洗涤液于试管中进行相关实验
B.抽滤前先用溶剂将滤纸湿润,使滤纸与漏斗底部贴紧
C.抽滤结束时应先关抽气泵,后抽掉抽滤瓶接管
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(6)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
阿司匹林(乙酰水杨酸,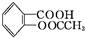 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
乙酸酐+水杨酸
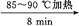
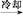
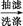 粗产品
粗产品
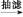
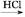
 乙酰水杨酸
乙酰水杨酸
(阿司匹林) 测熔点
测熔点
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |

 乙酰水杨酸
乙酰水杨酸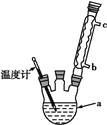
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验 小组 | 称取CuSO4 的质量/g | 装置C增加 的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
制备无水乙醇的实验原理:由于乙醇95.6%、水4.4%组成一种混合物,常压下,它有一定的沸点(78.17 ℃),这个沸点低于水的(100 ℃)也低于纯乙醇的沸点(78.3 ℃),所以只靠简单蒸馏酒精,所得乙醇纯度最高只能达到95.6%,尚含有4.4%的水。如果要得到含量较高的乙醇,在实验室中常用的简便方法是加入生石灰回流(回流是在一个可以加热的反应容器中,把液体加热使受热转化生成的蒸气通过冷凝器冷凝又回流到原容器的操作。见图甲),回流之后再蒸馏,可得99.5%的乙醇,通常称为无水乙醇。如果要得到纯度更高的绝对乙醇(含乙醇99.95%),则还要用金属钠进行处理,借以除去最后微量的水分。
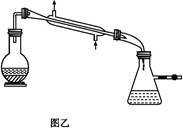
实验步骤:取干燥的250 mL圆底烧瓶一个,加入95%乙醇100 mL和小块生石灰30 g,振摇后用橡皮塞塞紧,放置过夜。在烧瓶口装上回流冷凝管,管口接一支氯化钙干燥管(装置见图甲),在水浴上加热回流1至2小时,稍冷,取下冷凝管,改装成蒸馏装置(如图乙),再放在热水浴中蒸馏,把最初蒸出的5 mL馏出液另外回收,然后用烘干的吸滤瓶作为接收器,其侧管接一支氯化钙干燥管,使其与大气相通,蒸至无液滴出来为止,量取所得乙醇的体积,计算回收率。请回答:
(1)为什么回收或蒸馏时都要装上氯化钙干燥管?
。
(2)为了防止回流系统外部湿气侵入,有人用塞子把冷凝管上端塞紧,这样做是否可行,为什么? 。
(3)无水氯化钙常用作吸水剂,如用无水氯化钙代替氧化钙投入酒精中,放置过夜,然后过滤。用此方法进行本实验制取乙醇是否可行,为什么?
。
(4)一般用干燥剂干燥有机物时,在蒸馏前应先过滤,但用氧化钙制备无水乙醇时,为什么可不过滤,留在瓶中一起蒸馏?
。
(5)为什么最初蒸出的5 mL馏出液另外收集,它的纯度是否已达99.5%?
。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。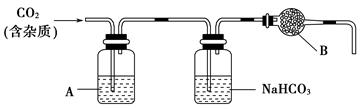
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是________(填字母,下同)。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是______溶液,NaHCO3溶液可以吸收________________。
(3)上述装置中,B物质是________。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重。为了将石蜡和碳酸钙溶出,应选用的试剂是________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________。
(6)上述测定实验中,连续________,说明样品已经恒重。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某活动小组对CuSO4分解产物除CuO外的气体的3种可能性进行假设,并通过实验确定气体的物质的量。
(1)气体的3种可能性为 ; ;有SO2、SO3和O2。
(2)为确定SO2、SO3和O2的物质的量之比,请你选用所给的仪器进行实验,按气体从左至右的方向连接各装置。顺序为: →B。(已知SO3溶于浓硫酸) 
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如右:
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为: 、 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 ;过滤操作②的滤液是_ 和 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为 ;
列式计算该成品的纯度 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com