
【题目】下列冶炼金属的原理正确的是
A. 电解食盐水制备金属钠 B. 电解氯化铝制备金属铝
C. 用MgO与CO热还原法制备单质镁 D. 加热分解Ag2O制备金属银
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】制备苯甲酸的反应原理及有关数据如下:

名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 溶解度 |
甲苯 | 92 | 无色液体 | -95℃ | 110℃ | 不溶于水 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122℃ | 248℃ | 微溶于水 |
高锰酸钾 | 158 | 易溶于水 |
实验过程如下: ①将高锰酸钾、水和氢氧化钠溶液混合摇匀后,加入甲苯,采用电磁搅拌,加热(但温度不要太高),冷凝回流2h。如仍有高锰酸钾的紫色存在,则加数滴乙醇。 ②将混合液过滤后冷却。③滤液用盐酸酸化,析出白色晶体过滤,洗涤,干燥,得到苯甲酸的粗产品,最后测定其熔点。回答下列问题:
(1)①中反应易暴沸,本实验中采用______方法防止此现象;乙醇的作用是____________________。
(2)②中过滤出的沉淀是____________________。
(3)③中测定熔点时,发现到130℃ 时仍有少量不熔,推测此不熔物的成分是____________________。
(4)提纯苯甲酸粗产品的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的描述不正确的是
A. 有机物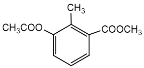 的核磁共振氢谱图中有4种类型的氢原子吸收峰
的核磁共振氢谱图中有4种类型的氢原子吸收峰
B. 用FeCl3溶液可以鉴别苯、苯酚、四氯化碳、KSCN、乙醇和AgNO3六种无色溶液或液体
C. 有机反应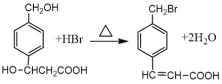 涉及取代反应和消去反应两种类型
涉及取代反应和消去反应两种类型
D. 1 mol 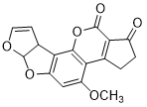 一定条件下最多可以与6 mol H2反应
一定条件下最多可以与6 mol H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某固体X(仅含两种短周期元素)的组成和性质。设计并完成如下实验:
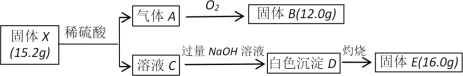
已知:气体A为氢化物,固体B是光导纤维的主要成分,固体E为耐高温材料。
请回答:
(1)固体X的化学式为__________。
(2)写出反应C→D的离子方程式__________。
(3)已知NH3与气体A在一定条件下反应后可得到一种耐高温材料(仅含两种元素,摩尔质量为140 g·mol-1)和H2,写出该反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表格是元素周期表的一部分,请按要求填空
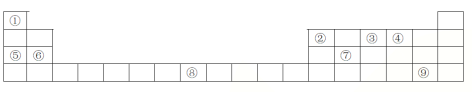
(1)元素①和⑤形成的化合物中存在的化学键类型为__________________
(2)写出由①②④形成的一种一元酸的分子式_________________
(3)写出由③形成的单质的电子式_________________
(4)列举元素⑦形成的氧化物一种用途________________;元素⑧在周期表中的位置 ____,
天津市有着丰富的海水资源,海水中元素⑤、⑥和⑨的含量很丰富,某化学兴趣小组先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。请回答下列问题
回答下列问题:
(5)海水淡化的方法主要是___________________________________(至少列举2种)
(6)采用“空气吹出法”从浓海水中吹出Br2,常温下,Br2的颜色为___________________。
吹出的溴用纯碱溶液吸收,吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+ NaHCO3(未配平),当吸收1mol Br2时,转移的电子数为________mol.
(7)从海水中获得元素⑤或⑥的化合物的一段工艺流程如图:
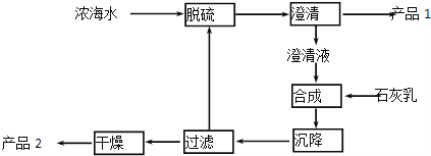
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,产品1的化学式为________________。产品2为Mg(OH)2。常温下向浓海水中滴加NaOH溶液,当Mg2+恰好完全沉淀时溶液的pH为_________。(已知25℃时Ksp[Mg(OH)2]=1.0×10-13)
(8)欲由MgCl2·6H2O加热制备MgCl2时,实验能取得成功的关键操作或条件是_________。
采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为_______________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.1 mol/L稀盐酸。
①该学生需要量取_____________ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填 “偏高”或“偏低”或“无影响”)。
a、用量筒量取浓盐酸时俯视观察凹液面。(____________)
b、用量筒量取浓盐酸后,洗涤量筒2-3次,洗涤液也转移到容量瓶。(_________)
(4)现将100mL 0.5mol/L的盐酸与200mL 0.1mol/LCuCl2溶液混合,体积变化忽略不计,所得溶液中Cl-的物质的量浓度是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列7种化学符号:![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]()
(1)表示核素的符号共______种。
(2)互为同位素的是______和______。
(3)质量数相等,但不能互为同位素的是______和______。
(4)中子数相等,但质子数不相等的是______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CaO+SO2 = CaSO3 ,2CaSO3 + O2 = 2CaSO4 。为了真正减轻煤燃烧产生的污染,你认为下列措施可取的是( )
A.尽量用大块状的燃煤B.通入过量的空气
C.煤粉中掺进适量的生石灰D.高烟囱降低污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关材料的叙述中,错误的是
A. 合金具有许多优良的物理、化学或机械性能
B. 硅单质是光导纤维的主要成分
C. 硅酸盐产品有陶瓷、玻璃、水泥等
D. 普通玻璃是以纯碱、石灰石和石英为原料制成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com