
【题目】制备苯甲酸的反应原理及有关数据如下:

名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 溶解度 |
甲苯 | 92 | 无色液体 | -95℃ | 110℃ | 不溶于水 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122℃ | 248℃ | 微溶于水 |
高锰酸钾 | 158 | 易溶于水 |
实验过程如下: ①将高锰酸钾、水和氢氧化钠溶液混合摇匀后,加入甲苯,采用电磁搅拌,加热(但温度不要太高),冷凝回流2h。如仍有高锰酸钾的紫色存在,则加数滴乙醇。 ②将混合液过滤后冷却。③滤液用盐酸酸化,析出白色晶体过滤,洗涤,干燥,得到苯甲酸的粗产品,最后测定其熔点。回答下列问题:
(1)①中反应易暴沸,本实验中采用______方法防止此现象;乙醇的作用是____________________。
(2)②中过滤出的沉淀是____________________。
(3)③中测定熔点时,发现到130℃ 时仍有少量不熔,推测此不熔物的成分是____________________。
(4)提纯苯甲酸粗产品的方法是____________________。
【答案】 电磁搅拌 过量的高锰酸钾可被乙醇还原成二氧化锰或除去过量的高锰酸钾 二氧化锰或MnO2 氯化钾或KCl 重结晶
【解析】一定量的甲苯和KMnO4溶液和氢氧化钠在加热条件下反应2h后停止反应,反应混合物为苯甲酸钾、氢氧化钾、二氧化锰和剩余的高锰酸钾,过量的高锰酸钾可以用乙醇除去,经过滤除去不溶物二氧化锰,滤液为苯甲酸钾、氢氧化钾溶液,加入盐酸酸化,过滤得白色固体为苯甲酸和氯化钾的混合物。
(1)根据题干信息,甲苯和KMnO4溶液在加热条件下反应,属于溶液之间的反应,在加热条件下进行,为了防止暴沸,必需加入碎瓷片,并进行不断的搅拌,所以可以用电磁搅拌完成这一操作;乙醇易溶于水,被氧化为二氧化碳和水,所以过量的高锰酸钾可以用乙醇除去,生成的二氧化锰通过过滤除去,所以乙醇的作用:除去过量的高锰酸钾溶液,正确答案:电磁搅拌;除去过量的高锰酸钾;
(2)根据分析可知,过滤所得沉淀是二氧化锰,正确答案:二氧化锰;
(3)通过测定白色固体苯甲酸的熔点,发现其在122℃开始熔化,达到130℃时仍有少量不熔,推测白色固体是苯甲酸与KCl的混合物,所以不熔物的成分是氯化钾,正确答案:氯化钾;
(4)利用苯甲酸和氯化钾的溶解度不同,通过重结晶的方法分离苯甲酸和氯化钾,除去苯甲酸中的氯化钾,所以正确答案:重结晶。


科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
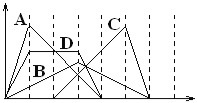
A. 向NaAlO2溶液中滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的A1C13溶液中滴入NaOH溶液至过量。
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无需其他操作,仅将①中物质加入(或通入)②中,预测的实验现象与实际相符的是
选项 | ① | ② | 预测现象 |
A | 久置氯水 | 紫色石蕊溶液 | 溶液先变红后褪色 |
B | 浓盐酸 | 二氧化锰 | 产生黄绿色气体 |
C | 二氧化碳气体 | 水玻璃 | 产生白色沉淀 |
D | 硫氰化钾溶液 | 氯化铁溶液 | 产生血红色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]我国首架国产大飞机C919采用具有自主知识产权的国产芳砜纶纤维,合成芳砜纶纤维的一种单体M的合成路线如下:
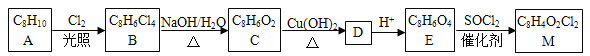
已知:①化合物B的核磁共振氢谱有2组峰
②一个碳原子上连两个羟基不稳定,会自动脱水,即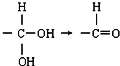
③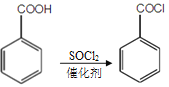
(1)A为芳香烃,请写出A的结构简式____________。
(2)B、C中所含官能团的名称分别为______________、____________。
(3)写出C与新制Cu(OH)2悬浊液反应生成D的化学方程式____________。
(4)E的化学名称为_____________,由E生成M的反应类型为____________。请写出E生成M的化学方程式____________。
(5)工业上用E与乙二醇反应来制涤纶,若涤纶的平均相对分子质量为10000,则其平均聚合度约为____________。
(6)B的同分异构体中能同时满足下列条件的共有_______种(不含立体异构)。
①属于芳香族化合物 ②Cl-不与苯环直接相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分:

请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序: _____________________;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________,若将其溶于水,破坏了其中的__________(填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4:1反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电脑显示屏生产过程中有大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)产生。某课题组以此粉末为原料回收铈,设计实验流程如下:
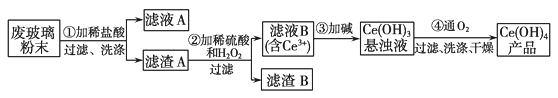
(1)滤渣A的主要成分是_____________;洗涤滤渣A除去的阳离子主要是________(填离子符号),检验该离子是否洗净的操作是________________________;
(2)步骤②中反应的离子方程式是_____________________;
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等;
(4)步骤④中反应化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.髙锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是_______________________________(用化学方程式表示)。
(2)第④步通人适量CO2,发生反应生成MnO4-、MnO2和碳酸盐,则发生反应的离子方程式为_______________________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_________________(用化学方程式表)。
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性髙锰酸钾溶液,则酸性髙锰酸钾溶液会褪色,写出该反应的离子方程式: ________________________________。
II.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和C12的性质。

(5)若从左端分别通入SO2和C12,装置A中观察到的现象是否相同______(填“相同”或“不相同”)。
(6)若装置B中装有5.0 mL 1.0 mol L-1的碘水,当通入足量Cl2完全反应后,共转移了5. 0×10-2 mol电子,则该反应的化学方程式为____________________________。
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4 : 3;当Cl2与含有X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加人氯化钡溶液,有白色沉淀产生。 写出Cl2与含有X的溶液反应的离子方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有_____(填序号)。
(3)请配平以下化学方程式:______
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH=
NaOH=![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_____L。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成 VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_____。
(5)V2O5 是两性氧化物,与强碱反应生成钒酸盐(阴离子为 VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出 V2O5 分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的原理正确的是
A. 电解食盐水制备金属钠 B. 电解氯化铝制备金属铝
C. 用MgO与CO热还原法制备单质镁 D. 加热分解Ag2O制备金属银
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com