
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电脑显示屏生产过程中有大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)产生。某课题组以此粉末为原料回收铈,设计实验流程如下:
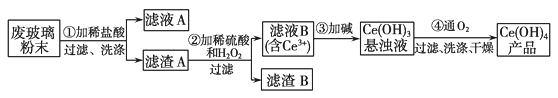
(1)滤渣A的主要成分是_____________;洗涤滤渣A除去的阳离子主要是________(填离子符号),检验该离子是否洗净的操作是________________________;
(2)步骤②中反应的离子方程式是_____________________;
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等;
(4)步骤④中反应化学方程式为______________________________。
【答案】SiO2、CeO2 Fe3+ 取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净;反之,未洗净 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O 不能 分液漏斗 4Ce(OH)3+O2+2H2O=4Ce(OH)4
【解析】
废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;加入碱后Ce3+转化为沉淀,最后通入氧气将Ce从+3氧化为+4,得到产品Ce(OH)4,据此解答。
(1)根据上述分析可知,加入稀盐酸时,Fe2O3与HCl反应产生FeCl3和水,SiO2、CeO2不能溶解,进入滤渣A中,因此滤液A的主要成分是Fe2O3与HCl反应产生的Fe3+;检验Fe3+的方法是取最后一次洗涤液,加入KSCN溶液,若不出现红色,则证明沉淀已洗净;反之,沉淀未洗净;
(2)稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:6H++H2O2+2CeO2=2Ce3++O2↑+4H2O;
(3)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,萃取剂与水互不相容,而且Ce3+在萃取剂中的溶解度比在水中的大,所以TBP不能与水互溶;实验室进行萃取操作时用到的主要玻璃仪器有分液漏斗、烧杯、玻璃棒、量筒等;
(4)Ce(OH)3与O2、H2O在加热时发生氧化还原反应,Ce(OH)3被氧化为Ce(OH)4,根据原子守恒、电子守恒,可得反应的化学方程式:4Ce(OH)3+O2+2H2O=4Ce(OH)4。


科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,进行的可逆反应为A(固) +3B(气)![]() 3C(气)。下列叙述中表明可逆反应一定达到平衡状态的是( )
3C(气)。下列叙述中表明可逆反应一定达到平衡状态的是( )
①C的生成与分解速率相等 ②单位时间内生成amolA和3amolB
③B的浓度不再变化 ④混合气体总的物质的量不再发生变化
⑤A、B、C的物质的量之比为1:3:3 ⑥混合气体的密度不再变化
A. ①②③B. ①③④⑥C. ①③⑥D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备并收集少量AlCl3。已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。
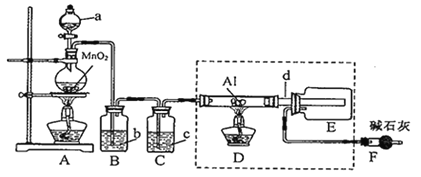
(1)a仪器的名称为_______;A装置中反应的化学方程式为_______。
(2)试剂b为_______。
(3)所用d导管较粗的原因是_______。
(4)F装置的作用为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,下列说法正确的是
2AB3(g) ΔH<0,下列说法正确的是
A. 升高温度,正、逆反应速率都加快,且正反应速率加快更明显
B. 升高温度能缩短达到平衡所需的时间且提高A2的转化率
C. 达到平衡后,同时升高温度和增大压强,n(AB3)有可能不变
D. 达到平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备苯甲酸的反应原理及有关数据如下:

名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 溶解度 |
甲苯 | 92 | 无色液体 | -95℃ | 110℃ | 不溶于水 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122℃ | 248℃ | 微溶于水 |
高锰酸钾 | 158 | 易溶于水 |
实验过程如下: ①将高锰酸钾、水和氢氧化钠溶液混合摇匀后,加入甲苯,采用电磁搅拌,加热(但温度不要太高),冷凝回流2h。如仍有高锰酸钾的紫色存在,则加数滴乙醇。 ②将混合液过滤后冷却。③滤液用盐酸酸化,析出白色晶体过滤,洗涤,干燥,得到苯甲酸的粗产品,最后测定其熔点。回答下列问题:
(1)①中反应易暴沸,本实验中采用______方法防止此现象;乙醇的作用是____________________。
(2)②中过滤出的沉淀是____________________。
(3)③中测定熔点时,发现到130℃ 时仍有少量不熔,推测此不熔物的成分是____________________。
(4)提纯苯甲酸粗产品的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在常温常压下:
①CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH=-354.8 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,充电一次可使手机连续使用一个月。
①该电池负极的电极反应式为________________________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)。阳极上最先发生的反应为___________________________;从各阶段的电解总反应方程式来看,最初是电解__________(填写化学式,下同)溶液,然后是电解________溶液,最后是电解H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯化铁溶液中加入足量的氨水:Fe3++3NH3·H2O == Fe(OH)3↓+3NH![]()
B. 氯气和水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. 铁和盐酸反应生成氢气:2Fe+6H+ == 2Fe3++3H2↑
D. BaCl2溶液中通入SO2:SO2+Ba2++H2O == BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物中分离出的活性化合物zeylastral的结构简式如图所示,下列说法错误的是( )
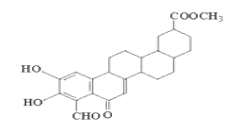
A. 1mol zeylastral最多与5molH2发生反应
B. 能与FeCl3溶液、银氨溶液发生反应
C. 化合物 zeylastral可以发生水解反应
D. 1mol zeylastral可与2molBr2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为_______________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.1 mol/L稀盐酸。
①该学生需要量取_____________ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填 “偏高”或“偏低”或“无影响”)。
a、用量筒量取浓盐酸时俯视观察凹液面。(____________)
b、用量筒量取浓盐酸后,洗涤量筒2-3次,洗涤液也转移到容量瓶。(_________)
(4)现将100mL 0.5mol/L的盐酸与200mL 0.1mol/LCuCl2溶液混合,体积变化忽略不计,所得溶液中Cl-的物质的量浓度是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com