
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。

(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。
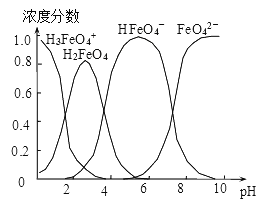
A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
【答案】 3:2 蒸发浓缩、冷却结晶、过滤、洗涤 用带火星的木条接触气体 K2FeO4在0℃时的溶解度比Na2FeO4、NaOH、KOH、Na2SO4小 酸式滴定管 CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH- 否,因为K2Cr2O7溶液为橙色、Fe3+的溶液为黄色,颜色变化不明显 0.792(或79.2%) A D
【解析】(1)本题考查氧化还原反应得失电子守恒,根据得失电子数目守恒,即n(KClO)×2=n[Fe(OH)3]×3,n(KClO):n[Fe(OH)3]=3:2;(2)本题考查物质的制备,①从FeSO4溶液中得到FeSO4固体,操作I的方法是蒸发浓缩、冷却结晶、过滤、洗涤得到FeSO4;②发生反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,气体X为O2,用带火星的木条接触气体,如果带火星的木条复燃,说明是氧气;③利用K2FeO4在0℃时的溶解度比Na2FeO4、NaOH、KOH、Na2SO4小;(3)本题考查滴定实验,①K2FeO4具有氧化性,能腐蚀橡胶,因此不能用带橡胶的碱式滴定管,步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中,所用的仪器应是酸式滴定管;②步骤3中发生反应是CrO2-+FeO42-→Fe(OH)3↓+CrO42-,Cr的化合价由+3价→+6价,化合价升高3价,Fe的化合价由+6价→+3价,化合价降低3价,最小公倍数为3,根据原子守恒和电荷守恒,配平其他,即离子反应方程式为:CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-;③因为K2Cr2O7溶液为橙色、Fe3+的溶液为黄色,颜色变化不明显,因此需要加指示剂;④根据反应方程式,建立关系式:6(NH4)2Fe(SO4)2~Cr2O72-~2CrO2-~2FeO42-,n(K2FeO4)=n[(NH4)2Fe(SO4)2]/3=30×10-3×0.1/3mol=0.001mol,K2FeO4的质量为0.001×198g=0.198g,其质量分数为0.198×4/1×100%=79.2%;(4)本题考查物料守恒等知识,A、由图中曲线可知,溶液pH=2时,不存在FeO42-,因此有c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1,故正确;B、向pH=10的溶液中加硫酸铵,溶液的pH逐渐减小,HFeO4-的分布分数逐渐增大,若加入硫酸铵较多,溶液酸性较强,则HFeO4-的分布分数先增大后逐渐减小,故错误;C、向pH=1的溶液中加HI溶液,HI具有还原性,H2FeO4有氧化性,发生氧化还原反应,故错误;D、pH=7时,HFeO4-和FeO42-共存,将K2FeO4晶体溶于水,FeO42-水解成HFeO4-,因此水溶液显碱性,故正确。


科目:高中化学 来源: 题型:
【题目】表中对于相关物质的分类全部正确的是
编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
A | 液氯 | 漂白粉 | Al2O3 | CO |
B | 醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
C | 碱石灰 | 盐酸 | K2O | Cl2 |
D | 胆矾 | 水玻璃 | CaO | SO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、科技、社会密切相关。下列说法正确的是
A. “可燃冰”是乙烷的水合物
B. 纤维素是人类重要的营养物质之一
C. 食用碘盐与非碘盐的“咸味”有较大的差异
D. 漂白粉、漂白液和漂白精均可作为游泳池的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl、![]() 、
、![]() 、
、![]() 、K+、Na+。为确认溶液组成进行如下实验:
、K+、Na+。为确认溶液组成进行如下实验:
①200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气
体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有 ,可能存在的离子有 ;
(2)原溶液中c(![]() )为 ,c(
)为 ,c(![]() ) c(
) c(![]() ) (填“>、<或=”);
) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl) c(![]() ) (填“>、<或=”)。
) (填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关100 mL 0.lmol·L-1 (NH4)2Fe(SO4)2溶液的叙述正确的是
A. 与K+、Na+、AlO2-、CO32-可以大量共存
B. 可用铁氰化钾溶液检验该溶液是否变质
C. 与100mL 0.1mol/L Ba(OH)2反应的离子方程式:Ba2++2OH-+SO42-+2NH4+=BaSO4↓+2NH3·H2O
D. 与足量酸性KMnO4溶液混合充分反应,共转移电子0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
__________Mn2++________H5IO6![]() __________
__________![]() +________
+________![]() +________H++________
+________H++________
(2)根据以上离子方程式判断H5IO6是________电离物质(填“易”或“难”)。
(3)上述反应,被氧化的元素是________(填元素符号),当1 mol Mn2+参加反应时,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是

A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:____________,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是____________。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+____________,BF3____________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应方程式____________、_________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解无关的是
A. 粗盐在空气中易潮解 B. NH4Cl用于金属焊接中除锈
C. 用热纯碱溶液去油污 D. 蒸干并灼烧FeCl3溶液得到Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com