



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:问答题
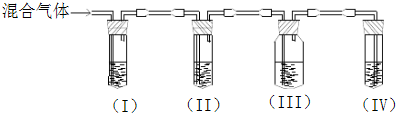
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验要求 | 试剂及方法 | 供选择的化学试剂及实验方法 A.通入溴水的洗气瓶 B.加热 C.通入盛饱和NaHCO3溶液的洗气瓶 D.向溶液中滴入酚酞试液 E.溶解、过滤、结晶 |
| 分离氯化钙、碳酸钙固体混合物 | ||
| 证明纯碱溶液呈碱性 | ||
| 除去食盐中的碘单质 | ||
| 除去CO2中少量氯化氢 | ||
| 判断中CH4是否含有C2H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.检验某溶液中是否含有SO42-,通常是先向试液中滴加BaCl2溶液,然后再滴加稀盐酸 |
| B.向某溶液中滴加稀氢氧化钠溶液,若未嗅到氨的气味,则说明该溶液中无铵盐 |
| C.某白色固体与强酸溶液接触产生大量无色气体,则该固体一定是碳酸钙 |
| D.检验某溶液中是否含有Fe3+,通常是向试液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分离KNO3和氯化钠,常用结晶与重结晶 |
| B.提纯含有碘的食盐,常用升华法 |
| C.去除乙醇中的水分常用蒸馏法 |
| D.分离苯和酸性高锰酸钾溶液可用分液法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
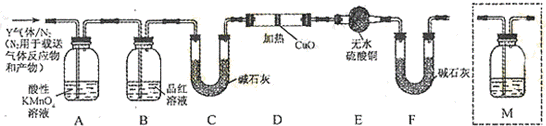
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com