
【题目】纯碱是一种非常重要的化学基本工业产品,工业上有很多不同的方法生产纯碱。
Ⅰ、路布兰法——其生产原理:用硫酸将食盐转化为硫酸钠,将硫酸钠与木炭、石灰石一起加热,得到产品和硫化钙。
(1)请写出上述过程的化学方程式:____________。
Ⅱ.索尔维制碱法:以食盐、氨气(来自炼焦副产品)和二氧化碳(来自石灰石)为原料,首先得到小苏打,再加热分解小苏打,获得纯碱。
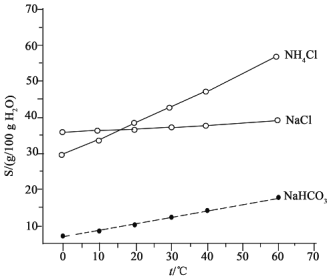
(2)结合下图中所给物质的溶解度曲线。写出得到小苏打的离子方程式:____________。
(3)这种生产方法的优点是原料便宜、产品纯度高、氨和部分二氧化碳可以循环使用。请写出实现氨循环的化学方程式:____________。
Ⅲ.侯德榜制碱法——生产流程可简要表示如下:
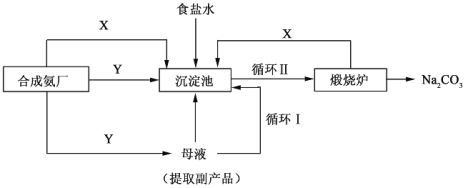
(4)合成氨工厂需要向制碱厂提供两种原料气体,其中Y是____________(填化学式),这两种气体在使用过程中是否需要考虑通入的先后顺序____________(填”是”或“否”),原因是____________。
(5)侯德榜制碱法保留了索尔维法的优点,克服了它的缺点,特别是设计了____________(填流程中的编号)使原料中溶质的利用率从70%提高到了96%以上。从母液中可以获得的副产品的应用:____________(举一例)。
(6)该合成氨厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其它损耗)的____________%(保留两位有效数字)。
【答案】
I.(1)2NaC1+H2SO4(浓)![]() Na2SO4+2HC1↑、Na2SO4+2C十CaCO3
Na2SO4+2HC1↑、Na2SO4+2C十CaCO3![]() CaS+Na2CO3+2CO2↑
CaS+Na2CO3+2CO2↑
II.(2)Na++NH3+H2O+CO2![]() NaHCO3↓+NH4+
NaHCO3↓+NH4+
(3)2NH4C1+Ca(OH)2![]() CaC12+2NH3↑+2H2O
CaC12+2NH3↑+2H2O
III.(4)NH3;是;氨气在食盐水中溶解度大,先通氨气再通入CO2会产生碳酸氢铵,有利于碳酸氢铵的析出
(5)循环I;作化肥(合理答案即可)
(6)54
【解析】
试题分析:Ⅰ、(1)根据用硫酸将食盐转化为硫酸钠,将硫酸钠与木炭、石灰石一起加热,得到产品和硫化钙,上述过程的化学方程式为2NaC1+H2SO4(浓)![]() Na2SO4+2HC1↑、Na2SO4+2C+CaCO3
Na2SO4+2HC1↑、Na2SO4+2C+CaCO3![]() CaS+Na2CO3+2CO2↑,故答案为:2NaC1+H2SO4(浓)
CaS+Na2CO3+2CO2↑,故答案为:2NaC1+H2SO4(浓)![]() Na2SO4+2HC1↑、Na2SO4+2C+CaCO3
Na2SO4+2HC1↑、Na2SO4+2C+CaCO3![]() CaS+Na2CO3+2CO2↑;
CaS+Na2CO3+2CO2↑;
Ⅱ.(2)根据溶解度曲线,碳酸氢钠溶解度较小,反应生成小苏打的离子方程式为Na++NH3+H2O+CO2![]() NaHCO3↓+NH4+,故答案为:Na++NH3+H2O+CO2
NaHCO3↓+NH4+,故答案为:Na++NH3+H2O+CO2![]() NaHCO3↓+NH4+;
NaHCO3↓+NH4+;
(3)生成的氯化铵与碱能够反应生成氨气,因此实现氨循环的化学方程式为2NH4C1+Ca(OH)2![]() CaC12+2NH3↑+2H2O,故答案为:2NH4C1+Ca(OH)2
CaC12+2NH3↑+2H2O,故答案为:2NH4C1+Ca(OH)2![]() CaC12+2NH3↑+2H2O;
CaC12+2NH3↑+2H2O;
Ⅲ.(4)合成氨工厂需要向制碱厂提供的两种原料气体为二氧化碳和氨气,根据流程图,Y是氨气;二氧化碳的溶解度不大,氨气极易溶于水,因此先通氨气再通入CO2会产生碳酸氢铵,有利于碳酸氢铵的析出,故答案为:NH3;是;氨气在食盐水中溶解度大,先通氨气再通入CO2会产生碳酸氢铵,有利于碳酸氢铵的析出;
(5)侯德榜制碱法保留了索尔维法的优点,克服了它的缺点,特别是设计了循环I,使原料中溶质的利用率从70%提高到了96%以上。从母液中可以获得氯化铵,可以用作化学肥料,故答案为:循环I;作化肥;
(6)由NH3制NO的产率是94%、NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×94%×89%=0.8366mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为![]() ×100%=54%;即制HNO3所用去的NH3的质量占总耗NH3质量的54%,故答案为:54。
×100%=54%;即制HNO3所用去的NH3的质量占总耗NH3质量的54%,故答案为:54。


科目:高中化学 来源: 题型:
【题目】如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
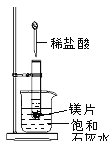
(1)实验中观察到的现象 。
(2)产生该现象的原因 。
(3)写出有关反应的离子反应方程 。
(4)有此推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟九号”载人飞船与天宫一号目标飞行器首次完美交会对接,标志着我国成功实现首次载人空间交会对接。“长征”系列火箭用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出该反应的化学方程式:________________________________________
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量______(填“大于”、“小于”或“等于”)生成物的总能量,断开化学键________的总能量小于形成化学键________的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。请回答下列问题:
,它可通过不同化学反应分别制得B、C、D和E四种物质。请回答下列问题:
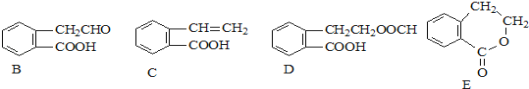
(1)在A~E五种物质中,互为同分异构体的是 (填代号)。
(2)写出由A生成D的化学方程式 。由A生成E的反应类型为 。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(4)C能形成高聚物,该高聚物的结构简式为 。
(5)写出一种区分D和E的试剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):

(1)Ⅰ的分子式为_____________;
(2)反应①的反应类型是_____________,反应④的反应类型是_____________。
(3)写出反应②的化学反应方程式____________ _________。
(4)香豆素在过量NaOH溶液中完全水解的化学方程式为_____________________。
(5)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写两种)。
(6)一定条件下,![]() 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A.Cl-、Br-、CrO42- B.CrO42-、Br、Cl- C.Br-、Cl-、CrO42- D.Br、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690pm和780pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备AlC13溶液,并用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备新型的超导材料和发光材料七铝十二钙 (12CaO·7Al2O3)。已知A1C13易水解,易升华。
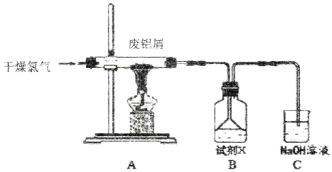
(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为____________;
②C装置的作用____________;
(2)氯气与废铝屑反应生成的AlC13蒸气溶解在B中,B中盛放的试剂X是____________;为了防止AlC13蒸气凝华堵塞导管,实验中可采取的措施是____________(写出一点)。
(3)B装置中的AlC13溶液溶解CaCO3时,AlC13溶液和碳酸钙粉末的混合方式为____________;
(4)实验要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是____________;
(5)以工业碳酸钙(含有少量A12O3、Fe2O3杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,____________。
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)

(实验中需用到的试剂和仪器有:盐酸,氢氧化钙,冰水,pH计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位置是________;
(2)甲的单质与水反应的离子方程式为____;乙单质与丙单质反应的化学方程式为_________。
(3)甲元素和丙元素的最高价氧化物对应水合物的碱性较强的是_______________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com