
【题目】Ⅰ.标准状况下有①6.72L CH4;②3.011023个HCl分子;③7.2gH2O,下列对这三种物质的关系从小到大的排列顺序是:(填写序号)
(1)物质的量______; (2)体积______;
(3)质量______; (4)氢原子数______。
Ⅱ.按要求写出相应的式子:
(1)过氧化钠与水反应的化学方程式:____________________________________;
(2)实验室制取氯气的离子方程式:______________________________________;
(3)铜与稀硝酸反应的离子方程式:______________________________________。
【答案】 ①〈③〈 ② ③〈①〈 ② ①〈③〈 ② ②〈③〈① 2Na2O2+2H2O =4NaOH+O2↑ MnO2+2Cl-+4H+ =△= Mn2++ Cl2↑+2H2O 3Cu+8H++2NO3-=2NO↑+3Cu2++4H2O
【解析】I、①.在标准状况下,6.72L CH4的物质的量是![]() =0.3mol,质量是0.3mol×16g/mol=4.8g,氢原子数是0.3mol×4=1.2mol;②. 3.01×1023个HCl分子的物质的量是
=0.3mol,质量是0.3mol×16g/mol=4.8g,氢原子数是0.3mol×4=1.2mol;②. 3.01×1023个HCl分子的物质的量是![]() =0.5mol,质量是0.5mol×36.5g/mol=17.25g,氢原子数是0.5mol,标准状况下的体积是0.5mol×22.4L/mol=11.2L;③7.2gH2O的物质的量是
=0.5mol,质量是0.5mol×36.5g/mol=17.25g,氢原子数是0.5mol,标准状况下的体积是0.5mol×22.4L/mol=11.2L;③7.2gH2O的物质的量是![]() =0.4mol,氢原子数是0.4mol×2=0.8mol,因标准状况下水是冰水混合物而不是气体,所以水的体积远远小于气体的体积。根据上述分析,(1)物质的量从小到大的顺序是:①〈③〈 ②;(2)体积从小到大的顺序是:③〈①〈 ②;(3)质量从小到大的顺序是:①〈③〈 ②;(4)氢原子数从小到大的顺序是:②〈③〈①。
=0.4mol,氢原子数是0.4mol×2=0.8mol,因标准状况下水是冰水混合物而不是气体,所以水的体积远远小于气体的体积。根据上述分析,(1)物质的量从小到大的顺序是:①〈③〈 ②;(2)体积从小到大的顺序是:③〈①〈 ②;(3)质量从小到大的顺序是:①〈③〈 ②;(4)氢原子数从小到大的顺序是:②〈③〈①。
II、(1)过氧化钠与水反应生成氢氧化钠和氧气,其化学方程式是:2Na2O2+2H2O =4NaOH+O2↑;(2)实验室制取氯气,采用的是二氧化锰和浓盐酸反应,所以其离子方程式是:MnO2+2Cl-+4H+ ![]() Mn2++ Cl2↑+2H2O;(3)铜与稀硝酸反应生成硝酸铜和NO以及水,所以其离子方程式:3Cu+8H++2NO3-=2NO↑+3Cu2++4H2O。
Mn2++ Cl2↑+2H2O;(3)铜与稀硝酸反应生成硝酸铜和NO以及水,所以其离子方程式:3Cu+8H++2NO3-=2NO↑+3Cu2++4H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】环保、安全的铝空气电池的工作原理如图所示,下列有关叙述错误的是( )
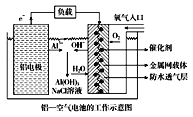
A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为O2+4e-+2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.煤转化为水煤气加以利用是为了节约燃料成本
B.用CO2合成可降解塑料聚碳酸酯,可实现“碳”的循环利用
C.纤维素、油脂、蛋白质均能作为人类的营养物质
D.铁粉和生石灰均可作为食品包装袋内的脱氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的说法正确的是( )
A.蔗糖与麦芽糖水解产物均能与新制氢氧化铜悬浊液反应
B.蔗糖与麦芽糖均能发生银镜反应
C.用溴水不能鉴别苯酚溶液、2,4-已二烯和甲苯
D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用图中所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用甲图装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是________(填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极为_______(填 “正” “负” “阴” “阳”)电极,发生反应的电极反应式为__________。
(3)实验过程中,SO42-________(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有_____。
Ⅱ.用乙图装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO![]() )在溶液中呈紫红色,且需碱性环境才可产生。
)在溶液中呈紫红色,且需碱性环境才可产生。
(4)电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为_______________和____________________。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2。该电池正极发生的反应的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 标况下,11.2L氟化氢中含有的分子数目为0.5NA
B. 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA
C. 室温下,2L 0.05mol/L的NH4NO3溶液中所含有的氮原子数目是0.2NA
D. 22.4L Cl2与足量NaOH溶液反应时转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Cl2的性质,下列说法不正确的是
A. Cl2有毒但可用于自来水消毒 B. 能与NaOH溶液反应生成两种盐
C. 能与Fe反应生成FeCl2 D. 一定条件下与H2反应产生苍白色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研宄性小组借助A﹣D的仪器装置完成有关实验. 
为了探究镀锌薄铁板上的锌的质量分数w (Zn)和镀层厚度,査询得知锌易溶于强碱; Zn+2NaOH=NaZnO2+H2↑.据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g.用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验.
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标.
(1)选用B和(填仪器标号)两个装置进行实验.
(2)测得充分反应后生成氢气的体枳为VL(标准状况),w (Zn)= .
(3)计算镀层厚度,还需要检索的一个物理量是 .
(4)若装置B中的恒压分液漏斗改为普通分液漏,测量结果将(填“偏大”、“偏小”或“无影响”).方案乙,通过称量试样与碱反应前后的质量实现探究目标.选用仪器做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g.
(5)w(Zn)= .
(6)从实验误差度分析,方案丙方案乙(“优于”、“劣于”或“等同于”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com