
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
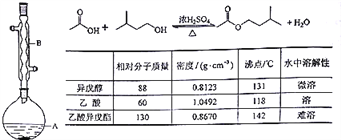
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
(1)仪器B的名称是:________________________。
(2)在洗涤操作中,第一次水洗的主要目的是:___________________________; 第二次水洗的主要目的是:________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_______(填标号)。
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:______________________。
(5)本实验的产率是___________(填标号)。
a. 30% b.40% c.60% d.90%
【答案】 球形冷凝管 除去乙酸和硫酸 除去NaHCO3 D 提高异戊醇的转化率 c
【解析】分析:(1)根据仪器构造回答仪器名称;
(2)根据含有的杂质以及物质性质分析两次洗涤的目的;
(3)根据物质的密度大小、溶解性和分液操作的实验步骤分析解答;
(4)从提高原料利用率的角度分析;
(5)产率等于实际产量与理论产量的比值。
详解:(1)由装置中仪器B的构造可以判断仪器B的名称为球形冷凝管;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;用饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,所以第二次水洗的主要目的是除去产品中残留的碳酸氢钠;
(3)因为酯的密度比水小,二者互不相溶,因此水在下层,酯在上层。分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的选项为D;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动,增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高异戊醇的转化率;
(5)乙酸的物质的量为6g÷60g/mol=0.1mol,异戊醇的物质的量为4.4g÷88g/mol=0.05mol,因为乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯。实际上生成的乙酸异戊酯的物质的量为3.9g÷130g/mol=0.03mol,所以乙酸异戊酯的产率为0.03mol/0.05mol×100%=60%,答案选c。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:

Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或性质与胶体没有直接关系的是 ( )
A. 在冶金厂和水泥厂常用高压电除去大量的烟尘,以减少其对空气的污染
B. 将植物油倒入水中用力振荡形成油水混合物
C. 清晨,阳光穿过茂密的林木枝叶所产生的美丽的光柱
D. 在Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
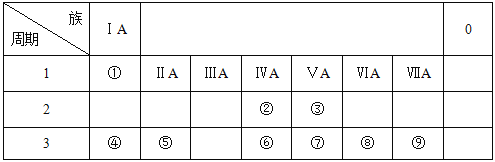
请按要求回答下列问题:
(1)⑧的原子结构示意图是__________;
(2)③、⑤、⑦三种元素的原子半径由大到小的顺序是 __________(填元素符号);
(3)元素②的气态氢化物比元素⑥的气态氢化物的稳定性较 __________(填 “强”或“弱”);
(4)④和⑨两种元素组成的化合物与AgNO3溶液反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下四种物质:A. ![]() ,B.Ca(ClO)2 ,C.NO2,D.Si,请根据题意,选择恰当的选项用字母代号填空。
,B.Ca(ClO)2 ,C.NO2,D.Si,请根据题意,选择恰当的选项用字母代号填空。
(1)漂白粉的有效成分是________;
(2)通常状况下带有特殊气味、不溶于水的液体是_______;
(3)通常状况下呈红棕色的是________;
(4)电子工业中作为半导体材料的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
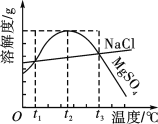
A. 只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B. t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C. 在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D. 把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com